البنزين: الصيغة. البنزين: الهيكل الإلكتروني ، الخصائص. الخواص الكيميائية للبنزين
البنزين مركب غير مشبع ، لكننا وجدنا أنه لا توجد روابط مزدوجة في بنيته ، بل رابطة عطرية - سحابة إلكترونية غير محددة التمركز. التفاعلات النموذجية للهيدروكربونات غير المشبعة - الإضافة الكهربية والأكسدة - ليست نموذجية للبنزين. لذلك ، فإنه لا يغير لون ماء البروم ، ولا يعطي تفاعل فاغنر (الأكسدة بمحلول برمنجنات البوتاسيوم في درجة حرارة الغرفة). يتميز البنزين بتفاعلات لا تؤدي إلى تعطيل النظام المترافق المغلق - تفاعلات الاستبدال. لمعرفة نوع الاستبدال (جذري ، محب للكهرباء ، محب للنيوكليوفيلي) الذي يميز البنزين ، تذكر هيكله الإلكتروني: الهيكل العظمي σ للجزيء مسطح ، والسحابة العطرية موجودة فوق وتحت المستوى. للتفاعل مع هذه السحابة العطرية ، يجب أن يكون الكاشف محبًا للكهرباء. لذلك ، بالنسبة للبنزين (والمركبات العطرية بشكل عام) تفاعلات الاستبدال الكهربية . أمثلة على تفاعلات S E هي:
في المرحلة الأولى ، تقترب المحبة الكهربائية من جزيء البنزين وتتفاعل مع السحابة العطرية بأكملها (تنجذب إلى بعضها البعض). تشكلت مركب π. هناك حاجة إلى زوج من الإلكترونات لتكوين رابطة تساهمية جديدة بين الكربون والكهرباء. تقوم المادة الكهربائية بإخراجها من السحابة العطرية مكونةً مركب σ. إنه ليس نظامًا مترافقًا مغلقًا لأن دخلت ذرة الكربون التي شكلت رابطة σ جديدة في تهجين sp 3 (خرجت من الطائرة ولم يعد لديها مدار p z غير هجين). تستمر ذرات الكربون الخمس المتبقية في المشاركة في الاقتران ، وتشكل سحابة إلكترونية مشتركة يتم فيها فصل أربعة إلكترونات (6-2 = 4) ، لذلك لا تتم الإشارة إلى الشحنة الموجبة في المركب على ذرة كربون محددة ، ولكن في مركز الحلقة المفتوحة. لذلك ، فإن مركب σ ليس بنية عطرية. من أجل استعادة الرائحة ، تحتاج إلى فصل بروتون الهيدروجين (H +). يتم تناوله بواسطة nucleophile (Nu -) المتبقي في وسط التفاعل. إلكترونين سندات C-Hبالعودة إلى السحابة العطرية ، تصبح ذرة الكربون مرة أخرى
sp 2 - مهجن ويمكن أن يشارك في الاقتران.
مرحلة تحديد المعدل لتفاعل الاستبدال الإلكتروفيلي هي مرحلة تكوين المركب σ ، حيث في هذه الحالة ، يحدث فقدان العطرية ، الأمر الذي يتطلب إنفاق الطاقة.
تستمر التفاعلات المختلفة للإحلال الكهربائي في البنزين وفقًا لـ آلية مشتركةوتختلف فقط في مرحلة تكوين الجسيمات المحبة للكهرباء.
تفاعل النتراتيستمر البنزين تحت تأثير خليط من أحماض النيتريك والكبريتيك المركزة (انظر مخطط التفاعل أعلاه). دعونا نفكر في آليتها.
 |
في المرحلة الأولى من التفاعل ، يتفاعل حمض النيتريك مع حامض الكبريتيك. في هذه الحالة ، يعمل حمض النيتريك كقاعدة ، حيث يقبل بروتونًا من جزيء حمض الكبريتيك (وفقًا لنظرية برونستيد ، فإن الحمض هو جزيء أو أيون يتبرع بالبروتون ، والقاعدة عبارة عن جزيء أو أيون يقبل بروتون الهيدروجين ). يتشكل حمض النيتريك البروتوني ، والذي ينفصل جزيء الماء ، ويتحول إلى كاتيون نيترونيوم ، أو كاتيون نيترونيوم. هذا هو الجسيم المحبة للكهرباء. وهكذا ، يعمل حمض الكبريتيك كعامل مساعد ، ويشارك في تكوين كاشف كهربائي. الدور الثاني لحمض الكبريتيك هو دور عامل نزع الماء. يجب إزالة الماء من مجال التفاعل من أجل تحويل توازنه إلى اليمين.
بعد تكوين الإلكتروفيل - كاتيون النترونيوم - يستمر التفاعل وفقًا لآلية عامة ، من خلال تكوين π- و
σ- مجمعات:
يرجى ملاحظة: في مرحلة تحول مركب إلى نيتروبنزين (مرحلة استعادة العطرية) ، ينفصل بروتون الهيدروجين تحت تأثير أنيون حامض الكبريتيك ، بينما يتشكل حمض الكبريتيك مرة أخرى ، مما يثبت ذلك كان العامل المساعد لهذا التفاعل.
 عامل حفاز تفاعلات الهالوجينهي ما يسمى بأحماض لويس (وفقًا لنظرية لويس ، الأحماض عبارة عن جزيئات أو أيونات محايدة قادرة على قبول زوج من الإلكترونات): FeCl 3 ، FeBr 3 ، AlCl 3 ، AlBr 3 ، إلخ. هناك حاجة إلى محفز لاستقطاب جزيء الهالوجين. يقوم حمض لويس بإزاحة زوج الإلكترون الوحيد من الكلور على نفسه ، مكونًا معقدًا تتركز فيه شحنة موجبة جزئية على إحدى ذرات الكلور:
عامل حفاز تفاعلات الهالوجينهي ما يسمى بأحماض لويس (وفقًا لنظرية لويس ، الأحماض عبارة عن جزيئات أو أيونات محايدة قادرة على قبول زوج من الإلكترونات): FeCl 3 ، FeBr 3 ، AlCl 3 ، AlBr 3 ، إلخ. هناك حاجة إلى محفز لاستقطاب جزيء الهالوجين. يقوم حمض لويس بإزاحة زوج الإلكترون الوحيد من الكلور على نفسه ، مكونًا معقدًا تتركز فيه شحنة موجبة جزئية على إحدى ذرات الكلور:
في مرحلة تكوين المركب ، يحدث مزيد من الاستقطاب لرابطة Cl-Cl ، وينكسر بشكل غير متجانس ، ويشارك Cl على الفور في تكوين المركب.
 المضي قدما بالمثل تفاعلات الألكلة(تفاعل فريدل كرافتس).
المضي قدما بالمثل تفاعلات الألكلة(تفاعل فريدل كرافتس).
 |
رابطة C-Cl في كلوريد الميثيل ليست قطبية بما يكفي للكسر بشكل غير متجانس. تحت تأثير حمض لويس ، تزداد الشحنة الموجبة الجزئية على ذرة الكربون ، ويكون مركب المادة المتفاعلة مع المحفز عبارة عن غلاف كهربائي أقوى من كلوريد ميثيل البداية.
تفاعل الكبريتاتيستمر البنزين تحت تأثير الأوليوم (محلول من أنهيدريد الكبريتيك SO 3 في حمض الكبريتيك المركز).
جزيء أنهيدريد الكبريتيك عبارة عن مركب كهربائي بسبب الشحنة الموجبة الجزئية الكبيرة على ذرة الكبريت.
 |
عندما يتم تكوين مركب π ، فإن الرابطة S = O (أولاً وقبل كل شيء ، الرابطة π) تكون مستقطبة ومكسورة بطريقة غير متجانسة ؛ لذلك ، عند تكوين مركب ، تظهر شحنة سالبة كلية على الأكسجين ذرة. لاستعادة العطرية ، ينفصل بروتون الهيدروجين عن ذرة الكربون في الحلقة ويمرر إلى الأكسجين سالب الشحنة. يتكون حمض بنزين سلفونيك.
عندما نفكر في تفاعلات الاستبدال الكهربية في البنزين ، فإننا لا نواجه السؤال في أي موضع يحدث التفاعل ، منذ ذلك الحين جميع ذرات الكربون متساوية تمامًا. شيء آخر هو إذا كانت حلقة البنزين تحتوي بالفعل على بديل. في هذه الحالة ، نتيجة للاستبدال الكهربائي ، يكون تكوين ثلاثة أيزومرات ممكنًا بشكل أساسي:
 |
للإجابة على سؤال أي من هذه المنتجات المحتملة هو الغالب ، من الضروري مراعاة التأثيرات الإلكترونية للبديل.
دعنا نستخرج من تفاعلات الاستبدال الكهربية في البنزين ومشتقاته وننظر في التأثيرات الإلكترونية بشكل عام.
التأثير المتبادل للذرات في الجزيئات العضوية
روابط. المؤثرات الإلكترونية
تؤثر الذرات والمجموعات الذرية في جزيئات المركبات العضوية على بعضها البعض ، وليس فقط الذرات المرتبطة مباشرة ببعضها البعض. ينتقل هذا التأثير بطريقة ما من خلال الجزيء. يسمى نقل تأثير الذرات في الجزيئات بسبب استقطاب الروابط بالتأثيرات الإلكترونية . هناك نوعان من التأثيرات الإلكترونية: التأثيرات الاستقرائية والتأثيرات المتوسطة.
تأثير حثي- هذا هو نقل تأثير البدائل على طول سلسلة روابط بسبب استقطابها. يُشار إلى التأثير الاستقرائي بالرمز الأول. فكر في ذلك باستخدام مثال 1-chlorobutane:
رابطة C-Cl قطبية بسبب ارتفاع كهرسلبية الكلور. تنشأ شحنة موجبة جزئية (δ +) على ذرة الكربون. يتم إزاحة زوج الإلكترون للرابطة التالية نحو ذرة الكربون التي تعاني من نقص الإلكترون ، أي مستقطب. نتيجة لذلك ، تنشأ أيضًا شحنة موجبة جزئية (+ ') على ذرة الكربون التالية ، إلخ. لذلك الكلور يستحثلا يقتصر الاستقطاب على رابطة σ "الخاصة" فحسب ، بل يستقطب أيضًا الروابط اللاحقة في السلسلة. يرجى ملاحظة أن كل شحنة موجبة جزئية لاحقة أقل من الشحنة السابقة (δ +> + '> δ +'> + '') ، أي ينتقل التأثير الاستقرائي من خلال الدائرة مع التخميد. يمكن تفسير ذلك من خلال انخفاض قابلية الاستقطاب لسندات. من المقبول عمومًا أن التأثير الاستقرائي يمتد إلى 3-4 روابط σ. في المثال المعطى ، تقوم ذرة الكلور بتحويل كثافة الإلكترون على طول سلسلة الرابطة لنفسي. يسمى هذا التأثير بالتأثير الاستقرائي السلبي ويشار إليه بواسطة -I Cl.
تظهر معظم البدائل تأثيرًا استقرائيًا سلبيًا ، منذ ذلك الحين يوجد في بنيتها ذرات أكثر كهرسلبية من الهيدروجين (يُفترض أن يكون التأثير الاستقرائي للهيدروجين صفرًا). على سبيل المثال: -F ، -Cl ، -Br ، -I ، -OH ، -NH 2 ، -NO 2 ،
-COOH ،> C = O.
 |  |
||
إذا قام البديل بتحويل كثافة الإلكترون على طول سلسلة روابط σ يدفع، فإنه يُظهر تأثيرًا استقرائيًا إيجابيًا (+ I). علي سبيل المثال:

يُظهر الأكسجين ذو الشحنة السالبة الكلية تأثيرًا استقرائيًا إيجابيًا.
![]()
في جزيء البروبين ، يتم تهجين كربون مجموعة الميثيل sp 3 ، ويتم تهجين ذرات الكربون في الرابطة المزدوجة sp 2 ، أي أكثر كهربية. لذلك ، تقوم مجموعة الميثيل بإزاحة كثافة الإلكترون بعيدًا عن نفسها ، مما يُظهر تأثيرًا استقرائيًا إيجابيًا (+ I CH 3).
لذلك ، يمكن أن يظهر التأثير الاستقرائي في أي جزيء توجد فيه ذرات ذات كهرسلبية مختلفة.
تأثير متوسط- هذا هو نقل التأثير الإلكتروني للبدائل في الأنظمة المترافقة ، من خلال استقطاب الروابط. ينتقل التأثير الوسيط بدون توهين ، لأن السندات سهلة الاستقطاب. يرجى ملاحظة: فقط تلك البدائل التي هي نفسها جزء من النظام المترافق لها تأثير متوسط. علي سبيل المثال:
يمكن أن يكون التأثير الوسيط موجبًا (+ M) وسالب (-M).
في جزيء كلوريد الفينيل ، يشارك زوج الإلكترون غير المشترك من الكلور في اقتران p ، π ، أي تكون مساهمة الكلور في النظام المترافق أكبر من مساهمة كل ذرة كربون. لذلك ، يُظهر الكلور تأثيرًا متوسطيًا إيجابيًا.
 جزيء الألدهيد الأكريليكي هو
جزيء الألدهيد الأكريليكي هو
π.π- نظام مترافق. تتبرع ذرة الأكسجين بإلكترون واحد للاقتران - مثل كل ذرة كربون ، ولكن الكهربية للأكسجين أعلى من تلك الخاصة بالكربون ، لذلك يغير الأكسجين كثافة الإلكترون للنظام المترافق تجاه نفسه ، وتعرض مجموعة الألدهيد ككل سلبيًا تأثير متوسط.
لذلك ، فإن البدائل التي تتبرع بإلكترونين للاقتران لها تأثير متوسط إيجابي. وتشمل هذه:
أ) البدائل ذات الشحنة السالبة الكلية ، على سبيل المثال ، –O - ؛
ب) البدائل ، التي يوجد في بنيتها ذرات بها أزواج إلكترونية غير مشتركة في مدارات p z ، على سبيل المثال: -NH 2 ، -OH ،
-F ، -Cl ، -Br- ، -I ، -OR (-OCH 3 ، -OC 2 H 5).
تُظهر البدائل التي تحول كثافة الإلكترون في النظام المترافق على نفسها تأثيرًا متوسطيًا سلبيًا. وتشمل هذه البدائل في هيكلها التي توجد روابط مزدوجة ، على سبيل المثال:
 |
يمكن أن يظهر البديل كلاً من التأثيرات الاستقرائية والميزومرية في وقت واحد. في بعض الحالات ، يكون اتجاه هذه التأثيرات هو نفسه (على سبيل المثال ، -I و -M) ، وفي حالات أخرى يعملان في اتجاهين متعاكسين (على سبيل المثال ، -I و + M). كيف تحدد في هذه الحالات التأثير العامبديل لبقية الجزيء (بمعنى آخر ، كيف يمكن تحديد ما إذا كان البديل المعطى هو متبرع للإلكترون أو متقبل للإلكترون)؟ البدائل التي تزيد من كثافة الإلكترون في باقي الجزيء تسمى بدائل التبرع بالإلكترون ، والبدائل التي تقلل من كثافة الإلكترون في باقي الجزيء تسمى بدائل سحب الإلكترون.
لتحديد التأثير الكلي للبديل ، من الضروري مقارنة تأثيراته الإلكترونية من حيث الحجم. إذا ساد تأثير الإشارة الإيجابية ، فإن البديل هو متبرع إلكتروني. إذا ساد التأثير السلبي ، فإن البديل هو بديل يسحب الإلكترون. تجدر الإشارة إلى أنه ، كقاعدة عامة ، يكون التأثير الميزومري أقوى من التأثير الاستقرائي (نظرًا لقدرة الروابط π الأكبر على الاستقطاب). ومع ذلك ، هناك استثناءات لهذه القاعدة: التأثير الاستقرائي للهالوجينات أقوى من التأثير المتوسط.
انصح أمثلة ملموسة:
في هذا المركب ، تعتبر المجموعة الأمينية بديلاً متبرعًا بالإلكترون ، لأن تأثيره الوسيط الإيجابي أكثر وضوحًا من التأثير الاستقرائي السلبي.
 في هذا المركب ، المجموعة الأمينية هي بديل يسحب الإلكترون ، لأن يظهر فقط تأثير استقرائي سلبي.
في هذا المركب ، المجموعة الأمينية هي بديل يسحب الإلكترون ، لأن يظهر فقط تأثير استقرائي سلبي.
في جزيء الفينول ، مجموعة الهيدروكسيل عبارة عن بديل متبرع بالإلكترون بسبب غلبة التأثير المتوسط الإيجابي على التأثير الحثي السلبي.
 في جزيء كحول البنزيل ، لا تشارك مجموعة الهيدروكسيل في الاقتران ولا تظهر سوى تأثير استقرائي سلبي. لذلك ، فهو بديل يسحب الإلكترون.
في جزيء كحول البنزيل ، لا تشارك مجموعة الهيدروكسيل في الاقتران ولا تظهر سوى تأثير استقرائي سلبي. لذلك ، فهو بديل يسحب الإلكترون.
توضح هذه الأمثلة أنه لا يمكن للمرء أن يأخذ في الاعتبار تأثير أي بديل بشكل عام ، ولكن يجب على المرء أن يأخذ في الاعتبار تأثيره في جزيء معين.
 فقط الهالوجينات هي دائمًا بدائل تسحب الإلكترون ، لأن تأثيرها الاستقرائي السلبي أقوى من التأثير المتوسط الإيجابي. علي سبيل المثال:
فقط الهالوجينات هي دائمًا بدائل تسحب الإلكترون ، لأن تأثيرها الاستقرائي السلبي أقوى من التأثير المتوسط الإيجابي. علي سبيل المثال:

الآن دعنا نعود إلى تفاعلات الاستبدال الإلكتروفيلي في مشتقات البنزين. لذلك ، اكتشفنا أن البديل الموجود بالفعل في الحلقة يؤثر على مسار تفاعلات الاستبدال الكهربية. ما هو هذا التأثير؟
يؤثر البديل على معدل تفاعلات SE وموضع البديل الثاني الذي يتم إدخاله في الحلقة. دعونا نفكر في كلا جانبي التأثير.
التأثير على معدل التفاعل. كلما زادت كثافة الإلكترون في الحلقة ، كلما كانت تفاعلات الاستبدال الكهربية أسهل. من الواضح أن البدائل المتبرعة بالإلكترون تسهل تفاعلات SE (فهي منشطات دورة) ، وبدائل سحب الإلكترون تعيقها (تقوم بإلغاء تنشيط الدورة). لذلك ، يتم إجراء تفاعلات الاستبدال الكهربية في مشتقات البنزين التي تحتوي على بدائل سحب الإلكترون في ظل ظروف أكثر شدة.
 دعنا نقارن نشاط الفينول والتولوين والبنزين والكلوروبنزين والنيترو بنزين في تفاعل النترات.
دعنا نقارن نشاط الفينول والتولوين والبنزين والكلوروبنزين والنيترو بنزين في تفاعل النترات.
نظرًا لأن الفينول والتولوين يحتويان على بدائل متبرعة بالإلكترون ، فإنهما أكثر نشاطًا في تفاعلات SE من البنزين. على العكس من ذلك ، فإن كلوروبنزين ونتروبنزين أقل نشاطًا في هذه التفاعلات من البنزين ، لأن تحتوي على بدائل سحب الإلكترون. الفينول أكثر نشاطًا من التولوين بسبب التأثير المتوسط الإيجابي لمجموعة OH. الكلور ليس قويًا كبديل لسحب الإلكترون مثل مجموعة النيترو ، لأن تعرض مجموعة النيترو كلاً من التأثيرات الوسيطة الاستقرائية السلبية والسلبية. حتى في هذا الصفينخفض النشاط في تفاعلات الاستبدال الكهربية من الفينول إلى النيتروبنزين. لقد ثبت تجريبياً أنه إذا تم أخذ معدل تفاعل نترات البنزين على أنه 1 ، فإن هذه السلسلة ستبدو كما يلي:
الجانب الثاني لتأثير البديل في الحلقة العطرية على مسار تفاعلات الاستبدال الكهربائي هو ما يسمى توجيه عمل البدائل. يمكن تقسيم جميع البدائل إلى مجموعتين: ortho- ، Par-orientants (بدائل من النوع الأول) و meta-orientants (بدائل من النوع الثاني).
ل بدائل من النوع الأولتشمل: -OH ، -O- ، -NH 2 ، مجموعات الألكيل (-CH 3 ، -C 2 H 5 إلخ) والهالوجينات. يمكنك أن ترى أن كل هذه البدائل تظهر تأثيرًا استقرائيًا إيجابيًا و / أو تأثيرًا متوسطيًا إيجابيًا. كلهم ، باستثناء الهالوجينات ، يزيدون من كثافة الإلكترون في الحلقة ، خاصة في مواضع ortho و para. لذلك ، يتم توجيه الكهربي إلى هذه المواقف. لنأخذ الفينول كمثال:
نظرًا للتأثير المتوسط الإيجابي لمجموعة الهيدروكسيل ، يتم إعادة توزيع كثافة الإلكترون على طول النظام المترافق ، وفي مواضع ortho و para يتم زيادتها بشكل خاص.
 عند معالجة الفينول بالبروم ، يتكون خليط من أورثو وبارا بروموفينول:
عند معالجة الفينول بالبروم ، يتكون خليط من أورثو وبارا بروموفينول:
إذا تم إجراء المعالجة بالبروم في مذيب قطبي (ماء بروم) وتم استخدام فائض من البروم ، يستمر التفاعل فورًا في ثلاثة أوضاع:
 |
بدائل من النوع الثانيهي: -NH 3 + ، -COOH ، -CHO (مجموعة الألدهيد) ، -NO 2 ، -SO 3 H. كل هذه البدائل تقلل كثافة الإلكترون في الحلقة العطرية ، ولكن نظرًا لإعادة توزيعها في المواضع الوصفية ، فهي ليست كذلك تم خفضه بنفس القوة ، كما هو الحال في ortho- و para-. ضع في اعتبارك هذا باستخدام مثال حمض البنزويك:
تُظهر مجموعة الكربوكسيل تأثيرات ميزومرية سلبية واستقرائية سلبية. نظرًا لإعادة التوزيع على طول النظام المترافق في المواضع الوصفية ، تظل كثافة الإلكترون أعلى مما كانت عليه في مواضع ortho و para ، وبالتالي فإن electrophile سوف تهاجم مواقع meta:
 |
المركبات العطرية هي تلك المركبات في الجزيء التي توجد فيها مجموعة حلقية من الذرات ذات طبيعة خاصة من الترابط - نواة البنزين. الاسم الدولي للهيدروكربونات العطرية هو الساحة.
أبسط ممثل للأرينات هو البنزين C 6 H 6. اقترح الكيميائي الألماني كيكول (1865) الصيغة التي تعكس بنية جزيء البنزين:
تشكل ذرات الكربون في جزيء البنزين مسدسًا منتظمًا مسطحًا ، على الرغم من أنه عادة ما يتم رسمه ممدودًا.
تم تأكيد بنية جزيء البنزين أخيرًا من خلال تفاعل تكوينه من الأسيتيلين. تُظهر الصيغة الهيكلية ثلاثة روابط كربون-كربون مفردة وثلاثية مزدوجة. لكن مثل هذه الصورة لا تنقل البنية الحقيقية للجزيء. في الواقع ، روابط الكربون-الكربون في البنزين متكافئة ، ولها خصائص لا تشبه تلك الموجودة في الروابط الفردية أو المزدوجة. يتم شرح هذه الميزات من خلال التركيب الإلكتروني لجزيء البنزين.
الهيكل الإلكتروني للبنزين.
تكون كل ذرة كربون في جزيء البنزين في حالة التهجين /> sp 2. وهي مرتبطة بذرتي كربون متجاورتين وذرة هيدروجين بثلاث روابط σ. نتيجة لذلك ، يتم تشكيل مسدس مسطح: جميع ذرات الكربون الست وجميع الروابط C-C و C-H تقع في نفس المستوى. سحابة الإلكترون للإلكترون الرابع (p-electron) ، التي لا تشارك في التهجين ، لها شكل الدمبل وموجهة بشكل عمودي على مستوى حلقة البنزين. تتداخل هذه السحب الإلكترونية من ذرات الكربون المجاورة فوق وتحت مستوى الحلقة 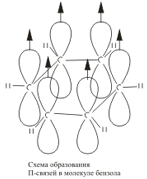 . نتيجة لذلك ، تشكل ستة إلكترونات p سحابة إلكترونية مشتركة ورابطة كيميائية واحدة لجميع ذرات الكربون. توجد منطقتان من المستوى الإلكتروني الكبير على جانبي مستوى الروابط σ
. نتيجة لذلك ، تشكل ستة إلكترونات p سحابة إلكترونية مشتركة ورابطة كيميائية واحدة لجميع ذرات الكربون. توجد منطقتان من المستوى الإلكتروني الكبير على جانبي مستوى الروابط σ  ./>/>
./>/>
ص- تسبب سحابة الإلكترون في تقليل المسافة بين ذرات الكربون. في جزيء البنزين ، هما متماثلان ويساويان 0.14 نانومتر. في حالة الرابطة المفردة والمزدوجة ، ستكون هذه المسافات 0.154 و 0.134 نانومتر ، على التوالي. هذا يعني أنه لا توجد روابط مفردة ومزدوجة في جزيء البنزين. جزيء البنزين عبارة عن دورة ثابتة من ستة أعضاء من مجموعات CH متطابقة تقع في نفس المستوى. جميع الروابط بين ذرات الكربون في البنزين متكافئة ، مما يحدد الخصائص المميزة لنواة البنزين. ينعكس هذا بدقة أكبر في الصيغة الهيكلية للبنزين في شكل مسدس منتظم مع دائرة بداخله (أنا ). (ترمز الدائرة إلى تكافؤ الروابط بين ذرات الكربون.) ومع ذلك ، غالبًا ما تُستخدم صيغة Kekule للإشارة إلى الروابط المزدوجة (ثانيًا
تعريف
البنزين(cyclohexatriene - 1،3،5) - مادة عضوية ، أبسط ممثل لعدد من الهيدروكربونات العطرية.
الصيغة - C 6 H 6 (الصيغة البنائية - الشكل 1). الوزن الجزيئي - 78 ، 11.
أرز. 1. الصيغ الهيكلية والمكانية للبنزين.
جميع ذرات الكربون الست في جزيء البنزين في الحالة الهجينة sp 2. تشكل كل ذرة كربون روابط 3σ مع ذرتي كربون أخريين وذرة هيدروجين واحدة في نفس المستوى. ست ذرات كربون تشكل مسدس منتظم (هيكل σ لجزيء البنزين). تحتوي كل ذرة كربون على مدار p غير مهجن ، والذي يحتوي على إلكترون واحد. تشكل ستة إلكترونات p سحابة إلكترون واحدة (نظام عطري) ، والتي يتم تصويرها على شكل دائرة داخل دورة مكونة من ستة أعضاء. يسمى الجذر الهيدروكربوني المشتق من البنزين C 6 H 5 - - phenyl (Ph-).
الخواص الكيميائية للبنزين
يتميز البنزين بتفاعلات الاستبدال التي تجري وفقًا للآلية الكهربية:
- الهالوجين (يتفاعل البنزين مع الكلور والبروم في وجود محفزات - AlCl 3 اللامائي ، FeCl 3 ، AlBr 3)
C 6 H 6 + Cl 2 \ u003d C 6 H 5 -Cl + HCl ؛
- نترات (يتفاعل البنزين بسهولة مع خليط نترات - خليط من أحماض النيتريك والكبريتيك المركزة)

- الألكلة مع الألكينات
C 6 H 6 + CH 2 \ u003d CH-CH 3 → C 6 H 5 -CH (CH 3) 2 ؛
تؤدي التفاعلات الإضافية للبنزين إلى تدمير النظام العطري ولا تستمر إلا في ظل ظروف قاسية:
- الهدرجة (يبدأ التفاعل عند تسخينه ، يكون المحفز هو Pt)

- إضافة الكلور (يحدث تحت تأثير الأشعة فوق البنفسجية مع تكوين منتج صلب - سداسي كلورو حلقي الهكسان (سداسي الكلور) - C 6 H 6 Cl 6)

مثل أي مركب عضوي ، يدخل البنزين في تفاعل احتراق بتكوين ثاني أكسيد الكربون والماء كمنتجات تفاعل (يحترق بلهب مدخن):
2C 6 H 6 + 15O 2 → 12CO 2 + 6H 2 O.
الخصائص الفيزيائية للبنزين
البنزين سائل عديم اللون ، ولكن له رائحة نفاذة معينة. يشكل خليطًا زيوتروبيًا مع الماء ، ويمتزج جيدًا مع الإيثرات والبنزين والمذيبات العضوية المختلفة. نقطة الغليان - 80.1 درجة مئوية ، نقطة الانصهار - 5.5 درجة مئوية. سام ، مادة مسرطنة (أي يساهم في تطور السرطان).
الحصول على البنزين واستخدامه
الطرق الرئيسية للحصول على البنزين:
- نزع الماء من الهكسان (المحفزات - Pt، Cr 3 O 2)
CH 3 - (CH 2) 4 -CH 3 → C 6 H 6 + 4H 2 ؛
- نزع الهيدروجين من الهكسان الحلقي (يستمر التفاعل عند تسخينه ، المحفز هو Pt)
ج 6 س 12 ← ج 6 س 6 + 4 س 2 ؛
- تقليم الأسيتيلين (يستمر التفاعل عند تسخينه إلى 600 درجة مئوية ، يكون المحفز عبارة عن كربون نشط)
3HC≡CH → C 6 H 6.
يستخدم البنزين كمادة خام لإنتاج المتماثلات (إيثيل بنزين ، كيومين) ، سيكلوهكسان ، نتروبنزين ، كلوروبنزين ، ومواد أخرى. في السابق ، كان البنزين يستخدم كمادة مضافة للبنزين لزيادة رقم الأوكتان الخاص به ، ولكن الآن ، نظرًا لسميته العالية ، يتم تنظيم محتوى البنزين في الوقود بشكل صارم. يستخدم البنزين في بعض الأحيان كمذيب.
أمثلة على حل المشكلات
مثال 1
| يمارس | اكتب المعادلات التي يمكنك من خلالها إجراء التحولات التالية: CH 4 → C 2 H 2 → C 6 H 6 → C 6 H 5 Cl. |
| قرار | للحصول على الأسيتيلين من الميثان ، يتم استخدام التفاعل التالي: 2CH 4 → C 2 H 2 + 3H 2 (ر = 1400 درجة مئوية). يمكن الحصول على البنزين من الأسيتيلين عن طريق تفاعل تقليم الأسيتيلين ، والذي يحدث عند التسخين (t = 600 درجة مئوية) وفي وجود الكربون المنشط: 3C 2 H 2 → C 6 H 6. يتم إجراء تفاعل الكلورة للبنزين للحصول على كلوروبنزين كمنتج في وجود كلوريد الحديد (III): C 6 H 6 + Cl 2 → C 6 H 5 Cl + HCl. |
مثال 2
| يمارس | إلى 39 جم من البنزين في وجود كلوريد الحديد (III) تمت إضافة 1 جزيء جرامي من ماء البروم. ما مقدار المادة وكم جرام من المنتجات التي نتج عنها هذا؟ |
| قرار | لنكتب معادلة تفاعل إضافة البروم للبنزين في وجود كلوريد الحديد (III): ج 6 H 6 + Br 2 → C 6 H 5 Br + HBr. نواتج التفاعل هي بروموبنزين وبروميد الهيدروجين. الكتلة المولية للبنزين ، محسوبة باستخدام الجدول العناصر الكيميائيةدي. منديليف - 78 جم / مول. أوجد كمية مادة البنزين: ن (ج 6 ح 6) = م (ج 6 س 6) / م (ج 6 ح 6) ؛ ن (C 6 H 6) = 39/78 = 0.5 مول. حسب حالة المشكلة ، تفاعل البنزين مع 1 مول من البروم. وبالتالي ، هناك نقص في المعروض من البنزين وسيتم إجراء مزيد من الحسابات للبنزين. وفقًا لمعادلة التفاعل n (C 6 H 6): n (C 6 H 5 Br): n (HBr) \ u003d 1: 1: 1 ، لذلك n (C 6 H 6) \ u003d n (C 6 H 5 Br) \ u003d: n (HBr) = 0.5 مول. بعد ذلك ، ستكون كتل بروموبنزين وبروميد الهيدروجين متساوية: م (ج 6 س 5 و) = ن (ج 6 س 5 و) × م (ج 6 س 5 و) ؛ م (HBr) = n (HBr) × M (HBr). الكتل المولية لبروموبنزين وبروميد الهيدروجين ، محسوبة باستخدام جدول العناصر الكيميائية لـ D.I. مندليف - 157 و 81 جم / مول ، على التوالي. م (C 6 H 5 Br) = 0.5 × 157 = 78.5 جم ؛ م (HBr) = 0.5 × 81 = 40.5 جم. |
| إجابه | نواتج التفاعل هي بروموبنزين وبروميد الهيدروجين. كتل بروموبنزين وبروميد الهيدروجين 78.5 و 40.5 جم على التوالي. |
الهيدروكربونات العطرية- مركبات الكربون والهيدروجين التي يوجد في جزيءها حلقة بنزين. أهم ممثلي الهيدروكربونات العطرية هو البنزين ومثيلاته - وهي منتجات استبدال ذرة هيدروجين واحدة أو أكثر في جزيء البنزين بمخلفات الهيدروكربون.
هيكل جزيء البنزين
تم اكتشاف أول مركب عطري ، البنزين ، في عام 1825 بواسطة M. Faraday. تم تثبيته الصيغة الجزيئية- C 6 H 6. إذا قارنا تركيبته مع تركيبة الهيدروكربون المشبع المحتوي على نفس العدد من ذرات الكربون - الهكسان (C 6 H 14) ، فيمكننا أن نرى أن البنزين يحتوي على ثمانية ذرات هيدروجين أقل. كما هو معروف ، يؤدي ظهور روابط ودورات متعددة إلى انخفاض عدد ذرات الهيدروجين في جزيء الهيدروكربون. في عام 1865 ، اقترح F.Kekule صيغته الهيكلية على شكل سيكلو هكسانترين - 1 ، 3 ، 5.

لذا فإن الجزيء المقابل ل صيغة كيكولي، يحتوي على روابط مزدوجة ، لذلك ، يجب أن يكون للبنزين طابع غير مشبع ، أي أنه من السهل الدخول في تفاعلات إضافية: الهدرجة ، المعالجة بالبروم ، الترطيب ، إلخ.
ومع ذلك ، فقد أظهرت بيانات العديد من التجارب أن البنزين يدخل في تفاعلات إضافة فقط في ظل ظروف قاسية (في درجات حرارة عالية وضوء) ، ومقاوم للأكسدة. أكثر ما يميزه هو تفاعلات الاستبدال ، لذلك فإن البنزين أقرب في طبيعته إلى الهيدروكربونات الهامشية.
في محاولة لشرح هذه التناقضات ، اقترح العديد من العلماء خيارات مختلفةهياكل البنزين. تم تأكيد بنية جزيء البنزين أخيرًا من خلال تفاعل تكوينه من الأسيتيلين. في الواقع ، روابط الكربون-الكربون في البنزين متكافئة ، وخصائصها لا تشبه خصائص الروابط الفردية أو المزدوجة.
حاليًا ، يُرمز للبنزين إما بصيغة كيكول ، أو بواسطة شكل سداسي تُصوَّر فيه دائرة.
![]()
إذن ما هي خصوصية بنية البنزين؟ بناءً على بيانات وحسابات الباحثين ، استنتج أن جميع ذرات الكربون الست موجودة في الحالة ص 2 التهجين والكذب في نفس المستوى. غير مهجن ص- المدارات من ذرات الكربون التي تشكل روابط مزدوجة (صيغة Kekule) متعامدة على مستوى الحلقة ومتوازية مع بعضها البعض.
تتداخل مع بعضها البعض ، وتشكل نظامًا واحدًا. وبالتالي ، فإن نظام الروابط المزدوجة المتناوبة الموصوفة في صيغة Kekule هو نظام دوري من روابط α مترافقة ومتداخلة. يتكون هذا النظام من منطقتين حلقيتين (شبه دائرية) من كثافة الإلكترون تقعان على جانبي حلقة البنزين. وبالتالي ، فمن المنطقي أكثر تصوير البنزين على أنه مسدس منتظم به دائرة في المركز (نظام π) أكثر من تصويره على أنه سيكلوهيكساترين -1،3،5. 
اقترح العالم الأمريكي L. Pauling تمثيل البنزين في شكل هيكلين حدوديين يختلفان في توزيع كثافة الإلكترون ويتحولان باستمرار إلى بعضهما البعض ، أي لاعتباره مركبًا وسيطًا ، "متوسط" من هيكلين.
تؤكد أطوال السندات المقاسة هذه الافتراضات. وجد أن جميع روابط C-C في البنزين لها نفس الطول (0.139 نانومتر). هم إلى حد ما أقصر من العزباء العلاقات C-C(0.154 نانومتر) ومضاعفات أطول (0.132 نانومتر).
هناك أيضًا مركبات تحتوي جزيئاتها على العديد من الهياكل الحلقية.

التماثل والتسمية
تتميز متماثلات البنزين بـ تماثل الموضع للعديد من البدائل. أبسط متجانس للبنزين ، التولوين (ميثيل بنزين) ، لا يحتوي على مثل هذه الأيزومرات ؛ يتم تقديم المتماثل التالي كأربعة أيزومرات:

أساس اسم الهيدروكربون العطري مع بدائل صغيرة هو الكلمة البنزين. يتم ترقيم الذرات في الحلقة العطرية من أعلى بديل إلى أصغرها:

وفقًا للتسمية القديمة ، يتم استدعاء الموضعين 2 و 6 مواقف أورثو, 4 - زوج-و 3 و 5 - استعارة.
الخصائص الفيزيائية
البنزين وأبسط متماثلاته في الظروف العادية هي سوائل شديدة السمية ذات خاصية رائحة كريهة. إنها ضعيفة الذوبان في الماء ، ولكنها جيدة - في المذيبات العضوية.
الخواص الكيميائيةالبنزين
تفاعلات الاستبدال. تدخل الهيدروكربونات العطرية في تفاعلات الاستبدال.
1. البروم.عند التفاعل مع البروم في وجود محفز ، بروميد الحديد (ΙΙΙ) ، يمكن استبدال إحدى ذرات الهيدروجين في حلقة البنزين بذرة بروم:

2. نترات البنزين ومثيلاته. عندما يتفاعل الهيدروكربونات العطرية مع حمض النيتريك في وجود حامض الكبريتيك (يسمى خليط من أحماض الكبريتيك والنتريك بخليط النيتريك) ، يتم استبدال ذرة الهيدروجين بمجموعة نيترو رقم 2:

عن طريق تقليل النيتروبنزين المتكون في هذا التفاعل ، يتم الحصول على الأنيلين - وهي مادة تستخدم للحصول على أصباغ الأنيلين:

رد الفعل هذا سمي على اسم الكيميائي الروسي زينين.
تفاعلات الإضافة.يمكن أن تدخل المركبات العطرية أيضًا في تفاعلات إضافة إلى حلقة البنزين. في هذه الحالة ، يتم تشكيل الهكسان الحلقي أو مشتقاته.
1. الهدرجة. الهدرجة التحفيزية للبنزين تستمر أكثر درجة حرارة عاليةمن هدرجة الألكينات:
![]()
2. الكلورة.يستمر التفاعل تحت الإضاءة بالأشعة فوق البنفسجية وهو جذر حر:

متماثلات البنزين
يتوافق تكوين جزيئاتهم مع الصيغة C n H 2 n-6. أقرب متماثلات للبنزين هي:
جميع متماثلات البنزين التي تلي التولوين لها أيزومرات. يمكن أن ترتبط التماكب بكل من عدد وهيكل البديل (1 ، 2) ، ومع موضع البديل في حلقة البنزين (2 ، 3 ، 4). مركبات الصيغة العامة C 8 H 10:

وفقًا للتسمية القديمة المستخدمة للإشارة إلى الموضع النسبي لبديلين متطابقين أو مختلفين في حلقة البنزين ، يتم استخدام البادئات أورثو- (اختصار o-) - توجد البدائل عند ذرات الكربون المجاورة ، ميتا(م-) - من خلال ذرة كربون واحدة و زوج— (ص-) - بدائل ضد بعضها البعض.
العناصر الأولى في السلسلة المتجانسة للبنزين هي سوائل لها رائحة معينة. إنها أخف من الماء. هم مذيبات جيدة.
تتفاعل متجانسات البنزين الاستبدال (المعالجة بالبروم والنترات). يتأكسد التولوين بالبرمنجنات عند تسخينه:

تستخدم متجانسات البنزين كمذيبات لإنتاج الأصباغ ومنتجات وقاية النباتات والبلاستيك والأدوية.



















الخصائص الفيزيائية
البنزين ومثيلاته هي السوائل عديمة اللون ذات الرائحة المعينة. الهيدروكربونات العطرية أخف من الماء ولا تذوب فيه ، لكنها تذوب بسهولة في المذيبات العضوية - الكحول ، الأثير ، الأسيتون.
البنزين ومثيلاته هم أنفسهم مذيبات جيدة للكثيرين المواد العضوية. تحترق جميع الساحات مع لهب مدخن على مرأى من محتوى عاليالكربون في جزيئاتهم.
يتم عرض الخصائص الفيزيائية لبعض المجالات في الجدول.
الطاولة. الخصائص الفيزيائية لبعض الساحات
|
اسم |
معادلة |
t ° .pl. ، |
t ° .bp. ، |
|
البنزين |
ج 6 ح 6 |
5,5 |
80,1 |
|
التولوين (ميثيل بنزين) |
ج 6 H 5 CH 3 |
95,0 |
110,6 |
|
إيثيل بنزين |
ج 6 س 5 ج 2 س 5 |
95,0 |
136,2 |
|
زيلين (ثنائي ميثيل بنزين) |
ج 6 H 4 (CH 3) 2 |
||
|
أورثو- |
25,18 |
144,41 |
|
|
ميتا |
47,87 |
139,10 |
|
|
زوج- |
13,26 |
138,35 |
|
|
بروبيل بنزين |
ج 6 H 5 (CH 2) 2 CH 3 |
99,0 |
159,20 |
|
كومين (أيزوبروبيل بنزين) |
ج 6 H 5 CH (CH 3) 2 |
96,0 |
152,39 |
|
ستايرين (فينيل بنزين) |
C 6 H 5 CH \ u003d CH 2 |
30,6 |
145,2 |
البنزين - غليان منخفض ( ركيب= 80.1 درجة مئوية) ، سائل عديم اللون ، غير قابل للذوبان في الماء
الانتباه! البنزين - السم ، يعمل على الكلى ، يغير تركيبة الدم (مع التعرض لفترات طويلة) ، يمكن أن يعطل بنية الكروموسومات.
معظم الهيدروكربونات العطرية سامة ومهددة للحياة.
الحصول على أرينيس (البنزين ومثيلاته)
في المختبر
1. اندماج أملاح حمض البنزويك مع القلويات الصلبة
C 6 H 5 -COONa + هيدروكسيد الصوديوم ر →ج 6 H 6 + Na 2 CO 3
بنزوات الصوديوم
2. تفاعل Wurtz-Fitting: (هنا G هو هالوجين)
من 6ح 5 -G + 2نا + ص-G →ج 6 ح 5 - ص + 2 ناجي
من 6 H 5 -Cl + 2Na + CH 3 -Cl → C 6 H 5 -CH 3 + 2NaCl
في الصناعة
- معزولة عن النفط والفحم عن طريق التقطير الجزئي ، والإصلاح ؛
- من قطران الفحم وغاز أفران الكوك
1. نزع الماء من الألكاناتمع أكثر من 6 ذرات كربون:
ج 6 ح 14 ر , كات→ C 6 H 6 + 4H 2
2. تثلث الأسيتيلين(للبنزين فقط) - تم العثور على R. زيلينسكي:
3С 2 H2 600 درجةج، يمثل. فحم→ ج 6 ح 6
3. نزع الهيدروجينالهكسان الحلقي ومثيلاته:
أثبت الأكاديمي السوفيتي نيكولاي دميترييفيتش زيلينسكي أن البنزين يتكون من الهكسان الحلقي (نزع الهيدروجين من الألكانات الحلقية
ج 6 ح 12 ر ، قطة→ C 6 H 6 + 3H 2

C 6 H 11 -CH 3 ر , كات→ C 6 H 5 -CH 3 + 3H 2
ميثيل سيكلوهكسانيتولوين
4. ألكلة البنزين(الحصول على متماثلات البنزين) - ص فريدل كرافتس.
C 6 H 6 + C 2 H 5-Cl ر ، AlCl3→ C 6 H 5-C 2 H 5 + حمض الهيدروكلوريك
كلوروإيثان إيثيل بنزين

الخواص الكيميائية للأرينات
أنا. تفاعلات الأكسدة
1. الاحتراق (لهب مدخن):
2ج 6 H 6 + 15O 2 ر→ 12CO 2 + 6H 2 O + Q
2. البنزين في ظل الظروف العادية لا يزيل لون ماء البروم و المحلول المائيبرمنجنات البوتاسيوم
3. تتأكسد متجانسات البنزين بواسطة برمنجنات البوتاسيوم (تغير لون برمنجنات البوتاسيوم):
أ) في بيئة حمضية لحمض البنزويك
تحت تأثير برمنجنات البوتاسيوم وغيره من المؤكسدات القوية على متماثلات البنزين ، تتأكسد السلاسل الجانبية. بغض النظر عن مدى تعقيد سلسلة البديل ، يتم تدميرها ، باستثناء ذرة الكربون ، والتي تتأكسد في مجموعة كربوكسيل.
تعطي متجانسات البنزين ذات السلسلة الجانبية الواحدة حمض البنزويك:
تعطي المتماثلات التي تحتوي على سلسلتين جانبيتين أحماض ثنائية القاعدة:
5C 6 H 5 -C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 → 5C 6 H 5 COOH + 5CO 2 + 6K 2 SO 4 + 12MnSO 4 + 28H 2 O
5C 6 H 5 -CH 3 + 6KMnO 4 + 9H 2 SO 4 → 5C 6 H 5 COOH + 3K 2 SO 4 + 6MnSO 4 + 14H 2 O
مبسط :
ج 6 H 5 -CH 3 + 3O KMnO4→ C 6 H 5 COOH + H 2 O
ب) في المحايدة والقلوية قليلاً لأملاح حمض البنزويك
C 6 H 5 -CH 3 + 2KMnO 4 → C 6 H 5 COO K + K OH + 2MnO 2 + H 2 O
ثانيًا. ردود الفعل الإضافية (أصعب من الألكينات)
1. الهالوجين
ج 6 H 6 + 3 كلوريد 2 ح ν → C 6 H 6 Cl 6 (سداسي كلورو حلقي الهكسان - سداسي كلوران)
2. الهدرجة
ج 6 س 6 + 3 س 2 ر , نقطةأوني→ ج 6 ح 12 (سيكلوهكسان)
3. البلمرة
ثالثا. تفاعلات الاستبدال - آلية أيونية (أخف من الألكانات)
1. الهالوجين -
أ ) البنزين
C 6 H 6 + Cl 2 AlCl 3 → C 6 H 5 -Cl + حمض الهيدروكلوريك (كلوروبنزين)
ج 6 H 6 + 6 كلوريد 2 ر ، AlCl3→ C 6 Cl 6 + 6HCl( سداسي كلور البنزين)
ج 6 ح 6 + فرع 2 ر ، FeCl3→ C 6 H 5 -Br + HBr( بروموبنزين)
ب) متماثلات البنزين عند التشعيع أو التسخين
من حيث الخصائص الكيميائية ، فإن جذور الألكيل تشبه الألكانات. يتم استبدال ذرات الهيدروجين فيها بالهالوجينات بآلية الجذور الحرة. لذلك ، في حالة عدم وجود محفز ، يؤدي التسخين أو الإشعاع فوق البنفسجي إلى تفاعل استبدال جذري في السلسلة الجانبية. يؤدي تأثير حلقة البنزين على بدائل الألكيل إلى حقيقة ذلك يتم دائمًا استبدال ذرة الهيدروجين عند ذرة الكربون المرتبطة مباشرة بحلقة البنزين (ذرة الكربون أ).
1) C 6 H 5 -CH 3 + Cl 2 ح ν → C 6 H 5 -CH 2 -Cl + حمض الهيدروكلوريك
ج) متماثلات البنزين في وجود محفز
C 6 H 5 -CH 3 + Cl 2 AlCl 3 → (خليط أورتي ، زوج من المشتقات) + حمض الهيدروكلوريك
2. النترات (مع حامض النيتريك)
ج 6 H 6 + HO-NO 2 ر ، H2SO4→ C 6 H 5 -NO 2 + H 2 O
نيتروبنزين - رائحة لوز!
C 6 H 5 -CH 3 + 3H O-NO 2 ر ، H2SO4→ من H 3 -C 6 H 2 (NO 2) 3 + 3H 2 O2،4،6-ثلاثي نيتروتولوين (تول ، تروتيل)
استخدام البنزين ومثيلاته
البنزين C 6 H 6 مذيب جيد. البنزين كمادة مضافة يحسن جودة وقود المحرك. إنه بمثابة مادة خام لإنتاج العديد من المركبات العضوية العطرية - نيتروبنزين C 6 H 5 NO 2 (مذيب ، يتم الحصول على الأنيلين منه) ، كلوروبنزين C 6 H 5 Cl ، الفينول C 6 H 5 OH ، ستيرين ، إلخ.
التولوين C 6 H 5 -CH 3 - مذيب يستخدم في تصنيع الأصباغ والعقاقير والمتفجرات (trotyl (tol) أو 2،4،6-trinitrotoluene TNT).
زيلينج 6 H 4 (CH 3) 2. الزيلين التقني هو خليط من ثلاثة ايزومرات ( أورثو-, ميتا- و زوج-xylenes) - يستخدم كمذيب ومنتج ابتدائي لتخليق العديد من المركبات العضوية.
ايزوبروبيل بنزينيستخدم C 6 H 5 -CH (CH 3) 2 للحصول على الفينول والأسيتون.
مشتقات الكلور للبنزينتستخدم لحماية النبات. وبالتالي ، فإن ناتج استبدال ذرات الهيدروجين في البنزين بذرات الكلور هو سداسي كلوروبنزين C 6 Cl 6 - مبيد للفطريات ؛ يتم استخدامه لتتبيل البذور الجافة للقمح والجاودار ضد التفحم القاسي. ناتج إضافة الكلور إلى البنزين هو سداسي كلورو حلقي الهكسان (سداسي كلوران) C 6 H 6 Cl 6 - مبيد حشري ؛ يتم استخدامه لمكافحة الحشرات الضارة. المواد المذكورة هي مبيدات - مواد كيميائيةالسيطرة على الكائنات الحية الدقيقة والنباتات والحيوانات.
ستيرين C 6 H 5 - CH \ u003d CH 2 يتبلمر بسهولة شديدة ، مكونًا بوليسترين ، وبلمرة مشتركة مع مطاط بوتادين - ستيرين بوتادين.
تجارب الفيديو



.jpg)
