ल्यूकोसाइट्स का मुख्य कार्य। लिम्फोग्रानुलोमैटोसिस (हॉजकिन की बीमारी) - कारण, लक्षण, निदान, उपचार और रोग का निदान
श्वेत रुधिराणु। ये पॉलीसेकेराइड लिफाफे के बिना परमाणु कोशिकाएं हैं।
आयाम - 9-16 माइक्रोन
9L . में सामान्य मात्रा 4-9*10 है
लाल अस्थि मज्जा, लिम्फ नोड्स, प्लीहा में शिक्षा होती है।
ल्यूकोसाइटोसिस - श्वेत रक्त कोशिकाओं की संख्या में वृद्धि
ल्यूकोपेनिया - श्वेत रक्त कोशिकाओं की संख्या में कमी
ल्यूकोसाइट्स की संख्या \u003d बी * 4000 * 20/400। वे गोरियाव ग्रिड पर भरोसा करते हैं। रक्त को एसिटिक एसिड के 5% घोल से पतला किया जाता है, जिसे मेथिलीन ब्लू से रंगा जाता है, 20 बार पतला होता है। अम्लीय वातावरण में, हेमोलिसिस होता है। फिर पतला रक्त एक मतगणना कक्ष में रखा जाता है। 25 बड़े वर्गों में संख्या गिनें। मतगणना अविभाजित और विभाजित वर्गों में की जा सकती है। श्वेत रक्त कोशिकाओं की कुल संख्या 400 छोटी के अनुरूप होगी। पता लगाएं कि प्रति व्यक्ति औसतन कितने ल्यूकोसाइट्स हैं छोटा वर्ग. घन मिलीमीटर में बदलें (4000 से गुणा करें)। हम 20 बार रक्त के कमजोर पड़ने को ध्यान में रखते हैं। नवजात शिशुओं में, पहले दिन मात्रा बढ़ाई जाती है (9 लीटर में 10-12 * 10)। 5-6 साल की उम्र तक यह एक वयस्क के स्तर तक पहुंच जाता है। ल्यूकोसाइट्स में वृद्धि से शारीरिक गतिविधि, भोजन का सेवन, दर्द, तनावपूर्ण स्थितियां. गर्भावस्था के दौरान ठंडक के साथ मात्रा बढ़ जाती है। यह एक शारीरिक ल्यूकोसाइटोसिस है जो संचलन में अधिक ल्यूकोसाइट्स की रिहाई से जुड़ा है। ये पुनर्वितरण प्रतिक्रियाएँ हैं। दैनिक उतार-चढ़ाव - सुबह कम ल्यूकोसाइट्स, शाम को अधिक। संक्रामक भड़काऊ रोगों में, सुरक्षात्मक प्रतिक्रियाओं में उनकी भागीदारी के कारण ल्यूकोसाइट्स की संख्या बढ़ जाती है। ल्यूकेमिया (ल्यूकेमिया) के साथ ल्यूकोसाइट्स की संख्या बढ़ सकती है
ल्यूकोसाइट्स के सामान्य गुण
- स्वतंत्र गतिशीलता (स्यूडोपोडिया गठन)
- केमोटैक्सिस (एक परिवर्तित रासायनिक संरचना के साथ फोकस के करीब पहुंचना)
- फागोसाइटोसिस (विदेशी पदार्थों का अवशोषण)
- डायपेडेसिस - संवहनी दीवार में घुसने की क्षमता
ल्यूकोसाइट सूत्र
- ग्रैन्यूलोसाइट्स
ए न्यूट्रोफिल 47-72% (खंडित (45-65%), छुरा (1-4%), युवा (0-1%))
बी ईोसिनोफिल्स (1-5%)
बी बेसोफिल्स (0-1%)
- एग्रानुलोसाइट्स (कोई ग्रैन्युलोसिटी नहीं)
ए लिम्फोसाइट्स (20-40%)
बी मोनोसाइट्स (3-11%)
ल्यूकोसाइट के विभिन्न रूपों का प्रतिशत - ल्यूकोसाइट सूत्र। रक्त स्मीयर गिनती। रोमानोव्स्की के अनुसार रंग। 100 ल्यूकोसाइट्स में से कितने इन किस्मों के हिसाब से होंगे। ल्यूकोसाइट सूत्र में, बाईं ओर एक बदलाव होता है (ल्यूकोसाइट के युवा रूपों में वृद्धि) और दाईं ओर (युवा रूपों का गायब होना और खंडित रूपों की प्रबलता)। दाईं ओर की पारी के निषेध की विशेषता है लाल अस्थि मज्जा का कार्य, जब नई कोशिकाएं नहीं बनती हैं, लेकिन केवल परिपक्व रूप मौजूद होते हैं। अब अनुकूल नहीं है। व्यक्तिगत रूपों के कार्यों की विशेषताएं। सभी ग्रैन्यूलोसाइट्स में कोशिका झिल्ली, चिपकने वाले गुण, केमोटैक्सिस, फागोसाइटोसिस और मुक्त गति की उच्च क्षमता होती है।
न्यूट्रोफिल ग्रैन्यूलोसाइट्सलाल अस्थि मज्जा में बनते हैं और 5-10 घंटे तक रक्त में रहते हैं। न्यूट्रोफिल में लाइसोसोमल, पेरोक्सीडेज, हाइड्रोलाइटिक, नाद-ऑक्सीडेज होते हैं। ये कोशिकाएं बैक्टीरिया, वायरस, विदेशी कणों के खिलाफ हमारे गैर-विशिष्ट रक्षक हैं। संक्रमण की उम्र में उनकी संख्या। संक्रमण की साइट केमोटैक्सिस के साथ संपर्क किया जाता है। वे फागोसाइटोसिस द्वारा बैक्टीरिया को पकड़ने में सक्षम हैं। मेचनिकोव द्वारा फागोसाइटोसिस की खोज की गई थी। Absonins, पदार्थ जो फागोसाइटोसिस को बढ़ाते हैं। इम्यून कॉम्प्लेक्स, सी-रिएक्टिव प्रोटीन, एग्रीगेटेड प्रोटीन, फाइब्रोनेक्टिन। ये पदार्थ विदेशी एजेंटों को कोट करते हैं और उन्हें सफेद रक्त कोशिकाओं के लिए "स्वादिष्ट" बनाते हैं। किसी विदेशी वस्तु के संपर्क में आने पर - फलाव। फिर इस बुलबुले का पृथक्करण होता है। फिर अंदर, यह लाइसोसोम के साथ फ़्यूज़ हो जाता है। इसके अलावा, एंजाइम (पेरोक्सीडेज, एडोक्सीडेज) के प्रभाव में, न्यूट्रलाइजेशन होता है। एंजाइम एक विदेशी एजेंट को तोड़ते हैं, लेकिन न्यूट्रोफिल स्वयं मर जाते हैं।
ईोसिनोफिल।वे हिस्टामाइन को फैगोसाइट करते हैं और एंजाइम हिस्टामाइन के साथ इसे नष्ट कर देते हैं। इसमें प्रोटीन होता है जो हेपरिन को नष्ट करता है। ये कोशिकाएं विषाक्त पदार्थों को बेअसर करने, प्रतिरक्षा परिसरों को पकड़ने के लिए आवश्यक हैं। ईोसिनोफिल्स एलर्जी प्रतिक्रियाओं में हिस्टामाइन को नष्ट कर देते हैं।
बेसोफिल -इसमें हेपरिन (एंटी-कौयगुलांट प्रभाव) और हिस्टामाइन (रक्त वाहिकाओं का विस्तार) होता है। मस्त कोशिकाएं जिनमें उनकी सतह पर इम्युनोग्लोबुलिन ई के लिए रिसेप्टर्स होते हैं। सक्रिय पदार्थ एराकिडोनिक एसिड के डेरिवेटिव हैं - प्लेटलेट सक्रिय करने वाले कारक, थ्रोम्बोक्सेन, ल्यूकोट्रिएन, प्रोस्टाग्लैंडीन। भड़काऊ प्रतिक्रिया के अंतिम चरण में बेसोफिल की संख्या बढ़ जाती है (उसी समय, बेसोफिल रक्त वाहिकाओं को पतला करते हैं, और हेपरिन भड़काऊ फोकस के पुनर्जीवन की सुविधा देता है)।
एग्रानुलोसाइट्स। लिम्फोसाइटों को विभाजित किया जाता है -
- 0-लिम्फोसाइट्स (10-20%)
- टी-लिम्फोसाइट्स (40-70%)। थाइमस में पूर्ण विकास। लाल अस्थि मज्जा में उत्पादित
- बी-लिम्फोसाइट्स (20%)। गठन का स्थान लाल अस्थि मज्जा है। लिम्फोसाइटों के इस समूह का अंतिम चरण छोटी आंत के साथ लिम्फोएफ़िथेलियल कोशिकाओं में होता है। पक्षियों में, वे पेट में एक विशेष स्मोक बर्सा में अपना विकास पूरा करते हैं।
रक्त में हमारे प्राकृतिक रक्षक भी होते हैं - लिम्फोसाइट्स। लिम्फोसाइट्स शरीर की प्रतिरक्षा प्रतिक्रियाओं के लिए केंद्रीय होते हैं, जो प्रतिरक्षा प्रणाली द्वारा किए जाते हैं।
इसे विशिष्ट और गैर-विशिष्ट प्रतिरक्षा में विभाजित किया गया है। हमारे पास जन्म से ही एक विशिष्ट प्रतिरक्षा प्रणाली है। प्रत्येक विभाजन में सेलुलर और विनोदी प्रतिरक्षा शामिल है। गैर-विशिष्ट प्रतिरक्षा प्रणाली। यह एक प्रतिरक्षा प्रतिक्रिया विकसित करने की प्रक्रिया है, जिसमें मोनोसाइट्स और मैक्रोफेज और हत्यारा कोशिकाएं (वायरस के खिलाफ) शामिल हैं। मैक्रोफेज प्रतिरक्षा प्रतिक्रिया का एक बहुत ही महत्वपूर्ण हिस्सा हैं। वे विदेशी प्रतिजनों के प्रोटीन दिखाते हैं। मैक्रोफेज फ्रैगमेंट एंटीजन को पकड़ लेते हैं। और मैं उन्हें एमएचसी प्रोटीन से जोड़ता हूं। यह कॉम्प्लेक्स - एंटीजन + एमएचसी प्रोटीन एंटीजन प्रस्तुति प्रदान करता है, जो विशिष्ट प्रतिरक्षा का कारण बनता है।
त्रिदोषन प्रतिरोधक क्षमतागैर-विशिष्ट प्रणाली में साइटोकिन्स (मोनोसाइट्स और मैक्रोफेज द्वारा निर्मित पदार्थ), पूरक प्रणाली (20 प्लाज्मा प्रोटीन का एंजाइमेटिक कैस्केड जो बैक्टीरिया या एंटीजन-एंटीबॉडी कॉम्प्लेक्स की दीवारों को नष्ट या तोड़ते हैं) और लाइसोजाइम शामिल हैं, जो एंजाइम की कोशिका की दीवारों को नष्ट कर देते हैं। बैक्टीरिया। लार में भी लाइसोजाइम पाया जाता है (इस वजह से लार में जीवाणुनाशक गुण होते हैं)
विशिष्ट प्रतिरक्षा प्रणाली
- सेलुलर प्रतिरक्षा में टी-लिम्फोसाइट्स शामिल हैं-
ए. टी-हेल्पर्स प्रतिरक्षा प्रणाली को उत्तेजित करते हैं
बी टी-सप्रेसर्स प्रतिरक्षा प्रणाली को दबाते हैं
B. टी-किलर विदेशी कोशिकाओं को नष्ट करते हैं
त्रिदोषन प्रतिरोधक क्षमताबी-लिम्फोसाइटों से प्राप्त प्लाज्मा कोशिकाओं द्वारा निर्मित एंटीबॉडी होते हैं।
बी लिम्फोसाइट्स पर विशिष्ट रिसेप्टर्स होते हैं और बी लिम्फोसाइट्स एक एंटीजन संलग्न करते हैं, और जब एंटीजन संलग्न होता है, तो यह प्राथमिक इम्युनोग्लोबुलिन प्रकार एम का उत्पादन करना शुरू कर देता है। इस इम्युनोग्लोबुलिन की उपस्थिति एक प्रोटीन द्वारा एमएचसी कॉम्प्लेक्स के गठन की अनुमति देती है। इस प्रोटीन के साथ प्रतिजन एंटीबॉडी के बाद के गठन के लिए प्रेरणा है, जो प्लाज्मा कोशिकाओं द्वारा होता है। लिम्फोसाइट्स लिम्फ नोड में चले जाते हैं और फिर एंटीबॉडी बनते हैं। यदि यह प्राथमिक पैठ है, तो प्रतिक्रिया 10-12 दिनों तक चलती है, लेकिन यदि इसे फिर से पेश किया जाता है, तो शरीर में स्मृति कोशिकाएं लड़ने लगती हैं। ल्यूकोसाइट्स में स्मृति कोशिकाएं होती हैं जो हमारे शरीर में वर्षों तक रह सकती हैं और उसी प्रतिजन के प्रकट होने की प्रतीक्षा करती हैं और रोग 2-3 दिनों में और अधिक तेजी से बंद हो जाता है
इम्युनोग्लोबुलिन को 5 वर्गों IgG (85%) में विभाजित किया गया है - सूक्ष्मजीवों और उनके विषाक्त पदार्थों से सुरक्षा, IgM (एंटीजन अटैचमेंट के लिए प्राथमिक ग्लोब्युलिन), IgA (लैक्रिमल द्रव, लार के स्राव में निहित, जठरांत्र पथ, हमें वायरस से बचाता है), IgD (यह एलर्जी प्रतिक्रियाओं के दौरान बेसोफिल और मस्तूल कोशिकाओं में बनता है। यह इम्युनोग्लोबुलिन ऑटोइम्यून प्रक्रियाओं में शामिल है। थायरॉयड ग्रंथि में, उदाहरण के लिए), IgE (विषाक्त पदार्थों के बेअसर होने में भाग लेता है और यह भी संबंधित है) एक्सोनिन, यानी प्रक्रियाओं को उत्तेजित करता है phagocytosis)। मोनोसाइट्स सबसे बड़ी श्वेत रक्त कोशिकाएं हैं। ये कोशिकाएं मैक्रोफेज में बदल सकती हैं। उनके पास एक अच्छी तरह से परिभाषित फागोसाइटोसिस है। वे न केवल बैक्टीरिया और वायरस, बल्कि ऊतक क्षय उत्पादों को भी फागोसाइटाइज कर सकते हैं, क्योंकि एक अम्लीय वातावरण में फागोसाइटोसिस को बनाए रखता है जब न्यूट्रोफिल फागोसाइटाइज करने की अपनी क्षमता खो देते हैं। ये कोशिकाएं विशिष्ट प्रतिरक्षा प्रतिक्रियाओं के लिए लिम्फोसाइटों को एंटीजन पेश करने में सक्षम हैं।
हेमटोपोइजिस।
रक्त कोशिकाओं के निरंतर नुकसान के लिए उनकी पुनःपूर्ति की आवश्यकता होती है। लाल अस्थि मज्जा में अविभाजित स्टेम कोशिकाओं से निर्मित। जिससे तथाकथित कॉलोनी-उत्तेजक (CFU) उत्पन्न होता है, जो सभी हेमटोपोइएटिक लाइनों के अग्रदूत हैं। इनसे द्वि और एकशक्ति दोनों कोशिकाएँ उत्पन्न हो सकती हैं। उनमें से, एरिथ्रोसाइट्स और ल्यूकोसाइट्स के विभिन्न रूपों का भेदभाव और गठन होता है।
1. प्रोएरिथ्रोब्लास्ट
2. एरिथ्रोब्लास्ट -
basophilic
अनेक रंगों का
ऑर्थोक्रोमैटिक (नाभिक खो देता है और रेटिकुलोसाइट बन जाता है)
3. रेटिकुलोसाइट (आरएनए और राइबोसोम अवशेष होते हैं, हीमोग्लोबिन का निर्माण जारी रहता है) 1-2 दिनों में 25-65 * 10 * 9 लीटर परिपक्व एरिथ्रोसाइट्स में बदल जाते हैं।
4. एरिथ्रोसाइट - हर मिनट 2.5 मिलियन परिपक्व लाल रक्त कोशिकाओं का निर्माण होता है।
एरिथ्रोपोएसिस को तेज करने वाले कारक
- एरिथ्रोपोइटिन (गुर्दे में गठित, यकृत में 10%)। वे माइटोसिस की प्रक्रियाओं को तेज करते हैं, रेटिकुलोसाइट के परिपक्व रूपों में संक्रमण को उत्तेजित करते हैं।
- हार्मोन - सोमाटोट्रोपिक, एसीटीएच, एंड्रोजेनिक, अधिवृक्क प्रांतस्था के हार्मोन, एरिथ्रोपोएसिस को रोकते हैं - एस्ट्रोजेन
- विटामिन - बी 6, बी 12 (बाहरी हेमटोपोइएटिक कारक, लेकिन अवशोषण तब होता है जब यह कैसल के आंतरिक कारक, जो पेट में बनता है), फोलिक एसिड के साथ जुड़ जाता है।
आपको लोहे की भी आवश्यकता है। ल्यूकोसाइट्स का निर्माण ल्यूकोपोइटिन नामक पदार्थों से प्रेरित होता है, जो ग्रैन्यूलोसाइट्स की परिपक्वता को तेज करता है और लाल अस्थि मज्जा से उनकी रिहाई को बढ़ावा देता है। ये पदार्थ ऊतक के टूटने के दौरान, सूजन के फॉसी में बनते हैं, जो ल्यूकोसाइट्स की परिपक्वता को बढ़ाता है। इंटरल्यूकिन्स हैं जो ल्यूकोइट्स के गठन को भी उत्तेजित करते हैं। वृद्धि हार्मोन और अधिवृक्क हार्मोन ल्यूकोसाइटोसिस (हार्मोन की संख्या में वृद्धि) का कारण बनते हैं। थाइमोसिन टी-लिम्फोसाइटों की परिपक्वता के लिए आवश्यक है। शरीर में ल्यूकोसाइट्स के 2 भंडार होते हैं - संवहनी - रक्त वाहिकाओं की दीवारों के साथ संचय और रोग स्थितियों में अस्थि मज्जा रिजर्व, अस्थि मज्जा से ल्यूकोसाइट्स (30-50 गुना अधिक) निकलते हैं।
रक्त का श्वसन कार्य।
ऑक्सीजन और कार्बन डाइऑक्साइड का परिवहन। निचले जानवरों में, यह प्रक्रिया सरल प्रसार द्वारा की जा सकती है; बहुकोशिकीय जानवरों में, विशेष की आवश्यकता होती है रासायनिक पदार्थ, जो गैस और श्वसन वर्णक ले जाते हैं, उच्च आंशिक दबावों पर ऑक्सीजन के साथ एक प्रतिवर्ती बंधन प्रदान करते हैं और कम दबाव में पीछे हटते हैं। सभी श्वसन एंजाइमों की एक विशेषता एक प्रोटीन और वर्णक भाग की उपस्थिति है, जिसमें एक धातु परमाणु शामिल है। यह एक ऑक्सीजन मेहतर है।
श्वसन वर्णक
- हीमोग्लोबिन - Fe+2
- क्लोरोक्रूरिन - Fe+2
- हेमरीथ्रिन - Fe+2
Fe+2 - इन पिगमेंट को लाल रंग देता है
- हेमोसायनिन Cu+2 - नीला रंग।
इसके गुणों के अनुसार ऑक्सीजन संलग्न करने के लिए हीमोग्लोबिन सबसे अच्छा होता है। इसमें सबसे अधिक ऑक्सीजन क्षमता होती है। पुरुषों में, मानदंड 130-180 ग्राम / लीटर है, महिलाओं में 115 - 165 ग्राम / एल
प्रत्येक हीमोग्लोबिन अणु में एक वर्णक और एक प्रोटीन भाग होता है। 4 सबयूनिट हैं - 2 अल्फा और 2 बीटा प्रोटीन चेन। प्रत्येक श्रृंखला में एक वर्णक समूह होता है। अल्फा में 141 एसिड अवशेष, बीटा - 146 होते हैं। ये 4 उपइकाइयां हीमोग्लोबिन की चतुर्धातुक संरचना बनाती हैं। कृत्रिम भाग का प्रतिनिधित्व किया जाता है - 4 पाइरोल के छल्ले, जो मिथाइल ब्रिज - सी-एच का उपयोग करके एक दूसरे से जुड़े होते हैं। संरचना के केंद्र में एक लोहा (2+) परमाणु है। लोहे की समन्वय संख्या 6 होती है। इसमें 6 बंधों की संभावना होती है। 4 - नाइट्रोजन परमाणुओं के साथ, 1 - संबंधित ग्लोबिन श्रृंखला के संबंध के लिए और एक ऑक्सीजन या अन्य पदार्थों के लगाव के लिए। अणु में, 96% ग्लोबिन है। हीम में 4% और आयरन में हीमोग्लोबिन 0.335% होता है
हीमोग्लोबिन हो सकता है अलग - अलग रूप- ए - 95-98% - वयस्क, हीमोग्लोबिन एफ - भ्रूण में भ्रूण (0.1-2%)। मायोग्लोबिन मांसपेशियों में होता है। असामान्य हीमोग्लोबिन C, E, I, J, S. उनमें अमीनो एसिड के अवशेष बदल जाते हैं। हीमोग्लोबिन S में, छठे स्थान पर ग्लूटामाइन वेलिन में बदल जाता है। सिकल सेल एनीमिया विकसित होता है। हीमोग्लोबिन की मात्रा, जो एक वयस्क में 100% - 167 ग्राम / लीटर होती है। पर्वतीय क्षेत्रों के निवासियों में लाल रक्त कोशिकाओं की मात्रा में वृद्धि के कारण नवजात शिशुओं में वृद्धि। सुबह में शाम की तुलना में अधिक हीमोग्लोबिन होता है, खाने के 2-3 घंटे बाद और पैथोलॉजी (एनीमिया विकसित होता है) के मामले में यह कम हो जाता है। क्लिनिक हीमोग्लोबिन सामग्री का उपयोग करके निर्धारित करता है वर्णमिति विधि
3 टेस्ट ट्यूब के साथ रैक। बीच में एक प्रयोगात्मक टेस्ट ट्यूब और 2 मानक टेस्ट ट्यूब हैं जिनमें हाइड्रोक्लोरिक एसिड हेमेटिन का समाधान होता है। एक प्रायोगिक परखनली में, हम रक्त में हीमोग्लोबिन की मात्रा का निर्धारण करते हैं, इसके लिए एक प्रयोगात्मक परखनली में 200 mm3 लिया जाता है। इसमें 20 मिमी3 रक्त डाला जाता है। हीमोग्लोबिन घोल में चला जाता है। 5 सेकंड के बाद, हेमेटिन हाइड्रोक्लोराइड बनता है। परखनली में आसुत जल डालें जब तक कि रंग मानक विलयन से मेल न खाए। पैमाने पर, हम परीक्षण करने वाले व्यक्ति में हीमोग्लोबिन की मात्रा निर्धारित करेंगे।
रंग सूचकांक (सीपीयू) - 0.7-1.1
CPU = Hb g/l उपयोग/ Hb g/l N को Er/l उपयोग/Er/l मानदंड से विभाजित किया जाता है
लिम्फोग्रानुलोमैटोसिस ( हॉडगिकिंग्स लिंफोमा)
- यह ट्यूमर है रक्त प्रणाली के रोग, जिसमें लसीकावत् ऊतक की परिपक्व कोशिकाओं से ट्यूमर कोशिकाएं बनती हैं ( संभवतः बी-लिम्फोसाइटों से) रोग की शुरुआत लिम्फ नोड्स के एक समूह के एक विशिष्ट घाव की विशेषता है जो ट्यूमर प्रक्रिया के अन्य अंगों में धीरे-धीरे फैलती है ( तिल्ली, जिगर और इतने पर) प्रभावित लिम्फ नोड्स में, हॉजकिन और रीड-बेरेज़ोव्स्की-स्टर्नबर्ग की ट्यूमर कोशिकाएं निर्धारित की जाती हैं, जो इस बीमारी की एक विशिष्ट विशेषता है।
रोग का कोर्स अपेक्षाकृत धीमा होता है, लेकिन उचित उपचार के बिना, कई आंतरिक अंगों की विफलता विकसित होती है, जिससे मृत्यु हो जाती है।
सभी मानव ट्यूमर रोगों की संरचना में, हॉजकिन का लिंफोमा लगभग 1% है। इस बीमारी की घटना प्रति वर्ष प्रति 1 मिलियन जनसंख्या पर 2-5 मामले हैं। रोग सभी उम्र के लोगों को प्रभावित कर सकता है, लेकिन घटना में दो चोटियाँ हैं - पहली - 20 से 30 वर्ष की आयु में ( लिम्फोग्रानुलोमैटोसिस की एक विशेषता क्या है?), और दूसरा - 50 वर्ष से अधिक आयु ( अधिकांश ट्यूमर की विशेषता) पुरुष महिलाओं की तुलना में 1.5 - 2 गुना अधिक बार बीमार पड़ते हैं।
रोचक तथ्य
- पहली बार रोग की नैदानिक तस्वीर का वर्णन 1832 में थॉमस हॉजकिन द्वारा किया गया था, जिसके नाम पर इसका नाम रखा गया था।
- सबमांडिबुलर लिम्फ नोड्स में वृद्धि बिल्कुल 80% में देखी गई है स्वस्थ लोग. लिम्फ नोड्स के अन्य समूहों में लंबे समय तक वृद्धि लिम्फोग्रानुलोमैटोसिस का संकेत हो सकता है।
- पर सही दृष्टिकोणलिम्फोग्रानुलोमैटोसिस पूरी तरह से ठीक हो सकता है ( दशकों तक छूट देखी जा सकती है).
- यूरोपीय लोगों की तुलना में जापानी और अफ्रीकी अमेरिकी हॉजकिन की बीमारी से कम बार बीमार पड़ते हैं।
ल्यूकोसाइट्स क्या हैं?
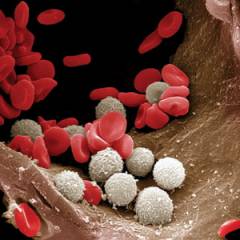 ल्यूकोसाइट्स, या सफेद रक्त कोशिका, रक्त कोशिकाओं का एक समूह कहा जाता है जो शरीर के सुरक्षात्मक कार्य प्रदान करता है - प्रतिरक्षा।
ल्यूकोसाइट्स, या सफेद रक्त कोशिका, रक्त कोशिकाओं का एक समूह कहा जाता है जो शरीर के सुरक्षात्मक कार्य प्रदान करता है - प्रतिरक्षा। ल्यूकोसाइट्स की संरचना और कार्य
ल्यूकोसाइट्स शरीर को दोनों बाहरी कारकों से बचाते हैं ( बैक्टीरिया, वायरस, विषाक्त पदार्थ), और आंतरिक क्षति से ( एंटीट्यूमर इम्युनिटी प्रदान करें) उनमें, सभी रक्त कोशिकाओं की तरह, एक कोशिका झिल्ली होती है जिसमें साइटोप्लाज्म होता है ( एक जीवित कोशिका का आंतरिक वातावरण), विभिन्न अंग ( सरंचनात्मक घटक) और जैविक रूप से सक्रिय पदार्थ। विशेष फ़ीचरल्यूकोसाइट्स उनमें एक नाभिक की उपस्थिति है, साथ ही साथ अपने स्वयं के रंग की अनुपस्थिति ( माइक्रोस्कोप के तहत ल्यूकोसाइट्स को केवल विशेष रंगों को लागू करके देखना संभव है).प्रदर्शन की गई संरचना और कार्य के आधार पर, निम्न हैं:
- बेसोफिल;
बड़ी सफेद रक्त कोशिकाएं एलर्जी और भड़काऊ प्रतिक्रियाओं के विकास में शामिल होती हैं। इनमें बड़ी संख्या में जैविक रूप से सक्रिय पदार्थ होते हैं ( सेरोटोनिन, हिस्टामाइन और अन्य), जो कोशिकाओं के नष्ट होने पर आसपास के ऊतकों में छोड़े जाते हैं। यह स्थानीय वासोडिलेशन की ओर जाता है ( और कुछ अन्य प्रतिक्रियाएं), जो सूजन के फोकस के लिए अन्य ल्यूकोसाइट्स की पहुंच की सुविधा प्रदान करता है।
न्यूट्रोफिल
वे सभी रक्त ल्यूकोसाइट्स का 45 से 70% हिस्सा बनाते हैं। न्यूट्रोफिल छोटे आकार की विदेशी सामग्री को अवशोषित करने में सक्षम हैं ( बैक्टीरिया के टुकड़े, कवक) विशेष पदार्थों के न्यूट्रोफिल के साइटोप्लाज्म में उपस्थिति के कारण अवशोषित कण नष्ट हो जाते हैं जिनमें जीवाणुरोधी प्रभाव होता है ( इस प्रक्रिया को फागोसाइटोसिस कहा जाता है) विदेशी कणों के अवशोषण और विनाश के बाद, न्युट्रोफिल आमतौर पर मर जाता है, बड़ी मात्रा में जैविक रूप से सक्रिय पदार्थों को आसपास के ऊतकों में छोड़ देता है, जिसमें जीवाणुरोधी गतिविधि भी होती है और सूजन प्रक्रिया का समर्थन करती है।
आम तौर पर, परिधीय रक्त में न्यूट्रोफिल के पूर्ण बहुमत को परिपक्व कोशिकाओं द्वारा दर्शाया जाता है जिनमें एक खंडित नाभिक होता है ( खंडित रूप) कम संख्या में, युवा न्यूट्रोफिल पाए जाते हैं, जिनमें एक खंड वाला एक लम्बा नाभिक होता है ( छुरा घोंपना) विभिन्न संक्रामक प्रक्रियाओं के निदान में यह अलगाव महत्वपूर्ण है, जिसमें न्यूट्रोफिल के युवा रूपों के पूर्ण और प्रतिशत में उल्लेखनीय वृद्धि हुई है।
मोनोसाइट्स
परिधीय रक्त में सबसे बड़ी कोशिकाएँ। वे अस्थि मज्जा में बनते हैं मनुष्य का मुख्य हेमटोपोइएटिक अंग) और 2 से 3 दिनों तक रक्त में घूमते हैं, जिसके बाद वे शरीर के ऊतकों में चले जाते हैं, जहां वे मैक्रोफेज नामक अन्य कोशिकाओं में बदल जाते हैं। उनका मुख्य कार्य विदेशी निकायों को अवशोषित और नष्ट करना है ( बैक्टीरिया, कवक, ट्यूमर कोशिकाएं), साथ ही उनके स्वयं के ल्यूकोसाइट्स जो सूजन के फोकस में मर गए। यदि हानिकारक एजेंट को नष्ट नहीं किया जा सकता है, तो बड़ी संख्या में मैक्रोफेज इसके चारों ओर जमा हो जाते हैं, जिससे तथाकथित कोशिका भित्ति बनती है, जो शरीर में रोग प्रक्रिया के प्रसार को रोकती है।
लिम्फोसाइटों
लिम्फोसाइटों का हिस्सा शरीर में सभी ल्यूकोसाइट्स का 25 से 40% हिस्सा होता है, लेकिन उनमें से केवल 2 - 5% परिधीय रक्त में होते हैं, और बाकी - विभिन्न अंगों के ऊतकों में। ये प्रतिरक्षा प्रणाली की मुख्य कोशिकाएं हैं जो अन्य सभी ल्यूकोसाइट्स की गतिविधि को नियंत्रित करती हैं, और स्वयं एक सुरक्षात्मक कार्य करने में भी सक्षम हैं।
समारोह के आधार पर, वहाँ हैं:
- बी-लिम्फोसाइट्स।एक विदेशी एजेंट के संपर्क में आने पर, ये कोशिकाएं विशेष एंटीबॉडी का उत्पादन करना शुरू कर देती हैं, जिससे इसका विनाश हो जाता है। कुछ बी-लिम्फोसाइट्स तथाकथित स्मृति कोशिकाओं में बदल जाते हैं, जो लंबे समय तक (सालों के लिए) एक विदेशी पदार्थ के बारे में जानकारी संग्रहीत करता है, और जब यह फिर से शरीर में प्रवेश करता है, तो यह एक त्वरित और मजबूत प्रतिरक्षा प्रतिक्रिया की ओर जाता है।
- टी-लिम्फोसाइट्स।ये कोशिकाएं सीधे विदेशी और स्वयं के ट्यूमर कोशिकाओं की पहचान और विनाश में शामिल होती हैं ( टी-हत्यारे) इसके अलावा, वे प्रतिरक्षा प्रणाली की अन्य कोशिकाओं की गतिविधि को नियंत्रित करते हैं, बढ़ाने ( टी-हेल्पर्स) या कमजोर ( टी शामक) प्रतिरक्षा प्रतिक्रिया।
- एनके सेल ( प्राकृतिक हत्यारे). उनका मुख्य कार्य अपने शरीर के ट्यूमर कोशिकाओं के साथ-साथ वायरस से संक्रमित कोशिकाओं का विनाश है।
इन पदार्थों की सांद्रता में वृद्धि इस तथ्य की ओर ले जाती है कि रक्त से घाव में और भी अधिक ल्यूकोसाइट्स बहने लगते हैं ( इस प्रक्रिया को केमोटैक्सिस कहा जाता है) वे हानिकारक एजेंट को बेअसर करने की प्रक्रिया में भी शामिल हैं, और उनके विनाश से और भी अधिक जैविक रूप से सक्रिय पदार्थों की रिहाई होती है। इसका परिणाम आक्रामक कारक या उसके अलगाव का पूर्ण विनाश हो सकता है, जो पूरे शरीर में आगे फैलने से रोकेगा।
ल्यूकोसाइट्स कहाँ बनते हैं?
अंतर्गर्भाशयी विकास के तीसरे सप्ताह के अंत में भ्रूण में पहली रक्त कोशिकाएं दिखाई देने लगती हैं। वे एक विशेष भ्रूण ऊतक से बनते हैं - मेसेनचाइम। भविष्य में, विकास के कुछ चरणों में, विभिन्न अंग हेमटोपोइएटिक कार्य करते हैं।हेमटोपोइएटिक अंग हैं:
- यकृत।इस अंग में हेमटोपोइजिस भ्रूण के विकास के 8-9 सप्ताह से शुरू होता है। भ्रूण में सभी रक्त कोशिकाओं का निर्माण यकृत में होता है। बच्चे के जन्म के बाद, यकृत का हेमटोपोइएटिक कार्य बाधित होता है, हालांकि, हेमटोपोइजिस का "निष्क्रिय" फॉसी इसमें रहता है, जिसे कुछ बीमारियों में फिर से सक्रिय किया जा सकता है।
- तिल्ली।अंतर्गर्भाशयी विकास के 11वें-12वें सप्ताह से शुरू होकर हेमटोपोइएटिक कोशिकाएं यकृत से प्लीहा की ओर पलायन करती हैं, जिसके परिणामस्वरूप इसमें सभी प्रकार की रक्त कोशिकाएं बनने लगती हैं। बच्चे के जन्म के बाद, यह प्रक्रिया आंशिक रूप से दबा दी जाती है, और तिल्ली प्रतिरक्षा प्रणाली के एक अंग में बदल जाती है, जिसमें भेदभाव होता है ( अंतिम परिपक्वता) लिम्फोसाइट्स।
- थाइमस ( थाइमस). यह ऊपरी छाती में स्थित एक छोटा अंग है। थाइमस का गठन अंतर्गर्भाशयी विकास के 4 वें सप्ताह के अंत में होता है, और 4-5 सप्ताह के बाद, यकृत से हेमटोपोइएटिक कोशिकाएं इसमें स्थानांतरित हो जाती हैं, जो टी-लिम्फोसाइटों में अंतर करती हैं। यौवन के बाद, थाइमस के आकार और कार्य में धीरे-धीरे कमी आती है ( उम्र का समावेश), और 40-50 वर्ष की आयु तक, थाइमस के आधे से अधिक भाग को वसा ऊतक द्वारा बदल दिया जाता है।
- लिम्फ नोड्स।भ्रूण के विकास के शुरुआती चरणों में, हेमटोपोइएटिक कोशिकाएं यकृत से लिम्फ नोड्स में स्थानांतरित हो जाती हैं, जो टी-लिम्फोसाइट्स और बी-लिम्फोसाइट्स में अंतर करती हैं। लिम्फ नोड्स में एकल लिम्फोसाइट्स भ्रूण के अंतर्गर्भाशयी विकास के 8 वें सप्ताह में पहले से ही निर्धारित किए जा सकते हैं, हालांकि, उनकी भारी वृद्धि 16 वें सप्ताह तक होती है। किसी व्यक्ति के जन्म के बाद, लिम्फ नोड्स एक सुरक्षात्मक कार्य भी करते हैं, जो पहले में से एक है सुरक्षात्मक बाधाएंजीव। जब विभिन्न बैक्टीरिया, वायरस या ट्यूमर कोशिकाएं लिम्फ नोड में प्रवेश करती हैं, तो वे लिम्फोसाइटों का एक बढ़ा हुआ गठन शुरू करते हैं, जिसका उद्देश्य खतरे को बेअसर करना और पूरे शरीर में इसके आगे प्रसार को रोकना है।
- लाल अस्थि मज्जा।अस्थि मज्जा एक विशेष पदार्थ है जो हड्डियों की गुहाओं में स्थित होता है ( श्रोणि, उरोस्थि, पसलियों और अन्य) प्रति चौथा महीनाअंतर्गर्भाशयी विकास, हेमटोपोइजिस के फॉसी इसमें दिखाई देने लगते हैं, और बच्चे के जन्म के बाद, यह रक्त कोशिकाओं के निर्माण का मुख्य स्थान है।
ल्यूकोसाइट्स कैसे बनते हैं?
ल्यूकोसाइट्स का निर्माण, अन्य रक्त कोशिकाओं की तरह, भ्रूण काल में शुरू होता है। उनके शुरुआती पूर्ववर्ती तथाकथित हेमटोपोइएटिक स्टेम सेल हैं। वे भ्रूण के अंतर्गर्भाशयी विकास की अवधि के दौरान दिखाई देते हैं और मानव शरीर में उसके जीवन के अंत तक प्रसारित होते हैं।स्टेम सेल काफी बड़ा होता है। इसके साइटोप्लाज्म में एक नाभिक होता है जिसमें डीएनए अणु होते हैं ( डिऑक्सीराइबोन्यूक्लिक अम्ल) डीएनए में कई सबयूनिट होते हैं - न्यूक्लियोसाइड, जिन्हें विभिन्न संयोजनों में एक दूसरे के साथ जोड़ा जा सकता है। डीएनए अणुओं में न्यूक्लियोसाइड्स की परस्पर क्रिया का क्रम और क्रम यह निर्धारित करता है कि कोशिका कैसे विकसित होगी, उसकी क्या संरचना होगी और यह कौन से कार्य करेगा।
नाभिक के अलावा, स्टेम सेल में कई अन्य संरचनाएं होती हैं ( अंगों), जो महत्वपूर्ण प्रक्रियाओं और चयापचय के रखरखाव प्रदान करते हैं। इन सभी घटकों की उपस्थिति स्टेम सेल को, यदि आवश्यक हो, रूपांतरित होने देती है ( अंतर) किसी भी रक्त कोशिका के लिए। विभेदन की प्रक्रिया कई क्रमिक चरणों में होती है, जिनमें से प्रत्येक में कोशिकाओं में कुछ परिवर्तन देखे जाते हैं। विशिष्ट कार्यों को प्राप्त करके, वे अपनी संरचना और आकार बदल सकते हैं, आकार में कमी कर सकते हैं, अपने नाभिक और कुछ अंग खो सकते हैं।
स्टेम सेल बनते हैं:
- मायलोपोइज़िस अग्रदूत कोशिकाएं;
- लिम्फोपोइजिस की पूर्वज कोशिकाएं।
इन कोशिकाओं में अंतर करने की अधिक सीमित क्षमता होती है। उनकी वृद्धि और विकास अस्थि मज्जा में होता है, और इसका परिणाम मुख्य रूप से परिपक्व सेलुलर तत्वों को रक्तप्रवाह में छोड़ना है।
मायलोपोइजिस के अग्रदूत कोशिकाओं से, निम्नलिखित बनते हैं:
- एरिथ्रोसाइट्स -रक्त के सबसे असंख्य कोशिकीय तत्व जो शरीर में ऑक्सीजन का परिवहन करते हैं।
- प्लेटलेट्स -छोटे प्लेटलेट्स जो रक्त वाहिकाओं के क्षतिग्रस्त होने पर रक्तस्राव को रोकने में शामिल होते हैं।
- कुछ प्रकार के ल्यूकोसाइट्सबेसोफिल, ईोसिनोफिल, न्यूट्रोफिल और मोनोसाइट्स।
अस्थि मज्जा में इन कोशिकाओं से, अपरिपक्व टी-लिम्फोसाइट्स और बी-लिम्फोसाइट्स बनते हैं, जो रक्तप्रवाह के साथ थाइमस, प्लीहा और लिम्फ नोड्स में स्थानांतरित हो जाते हैं, जहां उनके भेदभाव की प्रक्रिया समाप्त हो जाती है।
लिम्फोग्रानुलोमैटोसिस क्या है?
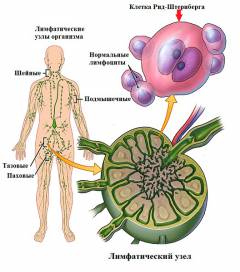 मानव शरीर में, कई उत्परिवर्तन लगातार होते रहते हैं, जो डीएनए अणुओं में न्यूक्लियोसाइड की गलत बातचीत पर आधारित होते हैं। इस प्रकार, हर मिनट हजारों संभावित ट्यूमर कोशिकाएं बनती हैं। सामान्य परिस्थितियों में, जब इस तरह के उत्परिवर्तन होते हैं, तो कोशिका आत्म-विनाश का एक आनुवंशिक रूप से क्रमादेशित तंत्र शुरू हो जाता है, जो इसके विकास और आगे प्रजनन को रोकता है। सुरक्षा का दूसरा स्तर शरीर की प्रतिरोधक क्षमता है। प्रतिरक्षा प्रणाली की कोशिकाओं द्वारा ट्यूमर कोशिकाओं का जल्दी पता लगाया जाता है और नष्ट कर दिया जाता है, जिसके परिणामस्वरूप ट्यूमर विकसित नहीं होता है।
मानव शरीर में, कई उत्परिवर्तन लगातार होते रहते हैं, जो डीएनए अणुओं में न्यूक्लियोसाइड की गलत बातचीत पर आधारित होते हैं। इस प्रकार, हर मिनट हजारों संभावित ट्यूमर कोशिकाएं बनती हैं। सामान्य परिस्थितियों में, जब इस तरह के उत्परिवर्तन होते हैं, तो कोशिका आत्म-विनाश का एक आनुवंशिक रूप से क्रमादेशित तंत्र शुरू हो जाता है, जो इसके विकास और आगे प्रजनन को रोकता है। सुरक्षा का दूसरा स्तर शरीर की प्रतिरोधक क्षमता है। प्रतिरक्षा प्रणाली की कोशिकाओं द्वारा ट्यूमर कोशिकाओं का जल्दी पता लगाया जाता है और नष्ट कर दिया जाता है, जिसके परिणामस्वरूप ट्यूमर विकसित नहीं होता है। यदि वर्णित तंत्र की गतिविधि बाधित होती है या अन्य अज्ञात कारणों के परिणामस्वरूप, उत्परिवर्ती कोशिका नष्ट नहीं होती है। यह प्रक्रिया लिम्फोग्रानुलोमैटोसिस को रेखांकित करती है, जिसमें एक ट्यूमर कोशिका का निर्माण होता है, संभवतः एक उत्परिवर्तित बी-लिम्फोसाइट से ( कुछ शोधकर्ताओं के अनुसार, ट्यूमर टी-लिम्फोसाइटों से बन सकता है) इस कोशिका में अनियंत्रित विभाजन की क्षमता होती है, जिसके परिणामस्वरूप इसकी कई प्रतियों का निर्माण होता है ( क्लोन).
लिम्फोग्रानुलोमैटोसिस में मुख्य ट्यूमर कोशिकाएं रीड-बेरेज़ोव्स्की-स्टर्नबर्ग कोशिकाएं और हॉजकिन कोशिकाएं हैं, जिनका नाम इस बीमारी के अध्ययन में शामिल वैज्ञानिकों के नाम पर रखा गया है। प्रारंभ में, ट्यूमर प्रक्रिया शरीर के लिम्फ नोड्स में से एक में इन कोशिकाओं की उपस्थिति के साथ शुरू होती है। यह कई सुरक्षात्मक प्रतिक्रियाओं की सक्रियता का कारण बनता है - कई ल्यूकोसाइट्स लिम्फ नोड में चले जाते हैं ( लिम्फोसाइट्स, न्यूट्रोफिल, ईोसिनोफिल और मैक्रोफेज), जिसका उद्देश्य पूरे शरीर में ट्यूमर कोशिकाओं के प्रसार और उनके विनाश को रोकना है। वर्णित प्रक्रियाओं का परिणाम ट्यूमर कोशिकाओं के चारों ओर एक कोशिका भित्ति का निर्माण और घने रेशेदार का निर्माण होता है ( सिकाट्रिकियल) स्ट्रैंड्स जो पूरे लिम्फ नोड में बढ़ते हैं, तथाकथित ग्रेन्युलोमा बनाते हैं। विकासशील भड़काऊ प्रतिक्रियाओं के कारण, लिम्फ नोड के आकार में उल्लेखनीय वृद्धि होती है।
जैसे-जैसे बीमारी बढ़ती है, ट्यूमर क्लोन अन्य लिम्फ नोड्स में स्थानांतरित हो सकते हैं ( जो लगभग सभी ऊतकों और अंगों के पास स्थित होते हैं), साथ ही साथ आंतरिक अंगों में, जिससे उनमें ऊपर वर्णित रोग संबंधी प्रतिक्रियाओं का विकास होगा। अंततः, सामान्य लिम्फ नोड ऊतक ( या अन्य प्रभावित अंग) ग्रेन्युलोमा बढ़ने से विस्थापित हो जाता है, जिससे इसकी संरचना और कार्यों का उल्लंघन होता है।
लिम्फोग्रानुलोमैटोसिस के कारण
कई अध्ययन किए गए हैं, जिसका उद्देश्य लिम्फोग्रानुलोमैटोसिस और सामान्य ऑन्कोजीन के संपर्क के बीच संबंधों की पहचान करना था। कारक जो किसी भी ट्यूमर रोग के विकास के जोखिम को बढ़ाते हैं) - आयनकारी विकिरण और विभिन्न रसायन, हालांकि, उनके बीच संबंध के अस्तित्व की पुष्टि करने वाले विश्वसनीय डेटा प्राप्त नहीं हुए हैं।
आज तक, अधिकांश शोधकर्ताओं की राय है कि संक्रामक एजेंट, साथ ही शरीर की प्रतिरक्षा प्रणाली के विभिन्न विकार, लिम्फोग्रानुलोमैटोसिस के विकास में महत्वपूर्ण भूमिका निभाते हैं।
लिम्फोग्रानुलोमैटोसिस के विकास के जोखिम को बढ़ाने वाले कारक हैं:
- वायरल रोग;
- इम्युनोडेफिशिएंसी स्टेट्स;
- आनुवंशिक प्रवृतियां।
वायरल रोग
वायरस डीएनए अणुओं के टुकड़े होते हैं जो शरीर की कोशिकाओं में प्रवेश करते हैं और उनके आनुवंशिक तंत्र में पेश किए जाते हैं, जिसके परिणामस्वरूप कोशिका नए वायरल टुकड़े उत्पन्न करना शुरू कर देती है। जब प्रभावित कोशिका नष्ट हो जाती है, तो नवगठित विषाणु अंतरकोशिकीय स्थान में प्रवेश करते हैं और पड़ोसी कोशिकाओं को संक्रमित करते हैं।एकमात्र कारक जिसका हॉजकिन के लिंफोमा के विकास पर प्रभाव साबित हुआ है, वह एपस्टीन-बार वायरस है, जो हर्पीसवायरस परिवार से संबंधित है और संक्रामक मोनोन्यूक्लिओसिस का कारण बनता है। वायरस मुख्य रूप से बी-लिम्फोसाइटों को संक्रमित करता है, जिससे उनका विभाजन और विनाश बढ़ जाता है। हॉजकिन रोग के आधे से अधिक रोगियों में रीड-बेरेज़ोव्स्की-स्टर्नबर्ग ट्यूमर कोशिकाओं के नाभिक में वायरस का डीएनए पाया जाता है, जो लिम्फोसाइटों के ट्यूमर अध: पतन में इसकी भागीदारी की पुष्टि करता है।
इम्युनोडेफिशिएंसी स्टेट्स
यह वैज्ञानिक रूप से सिद्ध हो चुका है कि अधिग्रहित प्रतिरक्षा कमी सिंड्रोम वाले लोग ( एड्स) लिम्फोग्रानुलोमैटोसिस की घटना के लिए पूर्वनिर्धारित हैं। सबसे पहले, यह एपस्टीन-बार वायरस सहित विभिन्न संक्रमणों के अनुबंध के बढ़ते जोखिम के कारण है। इसके अलावा, मानव इम्युनोडेफिशिएंसी वायरस (एचआईवी) एड्स पैदा करने वाला) टी-लिम्फोसाइटों को विकसित और संक्रमित करता है, जिससे शरीर की एंटीट्यूमर रक्षा में कमी आती है।हॉजकिन के लिंफोमा के विकास का जोखिम उन लोगों में भी थोड़ा बढ़ जाता है जो दवाएं लेते हैं जो प्रतिरक्षा प्रणाली को दबाते हैं ( ट्यूमर रोगों के उपचार में या अंग प्रत्यारोपण में).
आनुवंशिक प्रवृतियां
लिम्फोग्रानुलोमैटोसिस के लिए एक आनुवंशिक प्रवृत्ति की उपस्थिति जुड़वा बच्चों में इस बीमारी की अधिक लगातार घटना से प्रकट होती है यदि उनमें से एक बीमार है। हालांकि, आज तक, विशिष्ट जीन स्थापित करना संभव नहीं हुआ है, जिनकी उपस्थिति हॉजकिन के लिंफोमा की घटना की भविष्यवाणी करती है, इसलिए यह प्रश्न विज्ञान के लिए खुला रहता है।लिम्फोग्रानुलोमैटोसिस के लक्षण
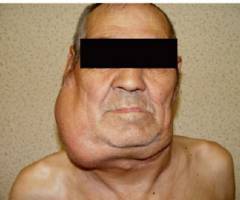 इस बीमारी की नैदानिक अभिव्यक्तियाँ बहुत विविध हैं। रोग बिना किसी लक्षण के लंबे समय तक आगे बढ़ता है और अक्सर विकास के बाद के चरणों में इसका निदान किया जाता है।
इस बीमारी की नैदानिक अभिव्यक्तियाँ बहुत विविध हैं। रोग बिना किसी लक्षण के लंबे समय तक आगे बढ़ता है और अक्सर विकास के बाद के चरणों में इसका निदान किया जाता है। हॉजकिन रोग की अभिव्यक्तियाँ हैं:
- सूजी हुई लसीका ग्रंथियां;
- आंतरिक अंगों को नुकसान के कारण लक्षण;
- रोग की प्रणालीगत अभिव्यक्तियाँ।
बढ़े हुए लिम्फ नोड्स ( लिम्फैडेनोपैथी)
लिम्फोग्रानुलोमैटोसिस की पहली और स्थायी अभिव्यक्ति लिम्फ नोड्स के एक या अधिक समूहों में वृद्धि है, जो पूर्ण कल्याण की पृष्ठभूमि के खिलाफ होती है। सबमांडिबुलर और सर्वाइकल लिम्फ नोड्स आमतौर पर पहले प्रभावित होते हैं ( आधे से अधिक मामलों में देखा गया), हालांकि, एक्सिलरी, वंक्षण, या लिम्फ नोड्स के किसी अन्य समूह का प्राथमिक घाव संभव है। वे बढ़ते हैं ( विशाल आकार तक बढ़ सकता है), घनी लोचदार स्थिरता बन जाते हैं, आमतौर पर दर्द रहित, आसानी से त्वचा के नीचे विस्थापित हो जाते हैं ( आसपास के ऊतकों को नहीं मिलाप).भविष्य में, प्रक्रिया ऊपर से नीचे तक फैलती है, छाती, पेट, श्रोणि अंगों और निचले छोरों के लिम्फ नोड्स को प्रभावित करती है। परिधीय लिम्फ नोड्स की हार आमतौर पर रोगी की भलाई में गिरावट के साथ नहीं होती है जब तक कि उनका आकार इतना बढ़ नहीं जाता है कि वे पड़ोसी ऊतकों और अंगों को संकुचित करना शुरू कर देते हैं, जिससे संबंधित लक्षणों की उपस्थिति होगी।
लिम्फोग्रानुलोमैटोसिस के साथ लिम्फ नोड्स में वृद्धि की सबसे आम अभिव्यक्तियाँ हो सकती हैं:
- खाँसी।यह तब प्रकट होता है जब ब्रोंची संकुचित हो जाती है और खांसी रिसेप्टर्स की जलन के परिणामस्वरूप होती है। आमतौर पर खांसी सूखी, दर्दनाक होती है, पारंपरिक एंटीट्यूसिव दवाओं से नहीं रुकती।
- सांस की तकलीफ।हवा की कमी की भावना फेफड़े के ऊतकों या श्वासनली और बड़ी ब्रांकाई के संपीड़न के परिणामस्वरूप हो सकती है, जिससे हवा का फेफड़ों में और बाहर जाना मुश्किल हो जाता है। वायुमार्ग संपीड़न की गंभीरता के आधार पर, अलग-अलग तीव्रता के शारीरिक परिश्रम के दौरान या आराम करने पर भी सांस की तकलीफ हो सकती है।
- निगलने का विकार।बढ़े हुए इंट्राथोरेसिक लिम्फ नोड्स अन्नप्रणाली के लुमेन को संकुचित कर सकते हैं, इसके माध्यम से भोजन के पारित होने को रोक सकते हैं। प्रारंभ में, ठोस और मोटे भोजन को निगलना मुश्किल होता है, और अंत में ( अन्नप्रणाली के गंभीर संपीड़न के साथ) - और तरल भोजन।
- शोफ।पूरे शरीर से शिरापरक रक्त बेहतर और अवर वेना कावा में एकत्र किया जाता है ( क्रमशः शरीर के ऊपरी और निचले हिस्सों से) जो हृदय में प्रवाहित होती है। वेना कावा को निचोड़ते समय, सभी अंगों में शिरापरक दबाव में वृद्धि होती है, जिससे रक्त इसमें बहता है। इसके परिणामस्वरूप, द्रव का हिस्सा संवहनी बिस्तर छोड़ देता है और आसपास के ऊतकों को संसेचित करता है, जिससे एडिमा बन जाती है। बेहतर वेना कावा का संपीड़न चेहरे, गर्दन, हाथों की सूजन से प्रकट हो सकता है। अवर वेना कावा का संपीड़न पैरों की सूजन और आंतरिक अंगों में वृद्धि की विशेषता है ( जिगर, प्लीहा) उनमें से रक्त के बहिर्वाह के उल्लंघन के परिणामस्वरूप।
- खट्टी डकार।आंत के कुछ हिस्सों को निचोड़ने से उसमें भोजन की उपस्थिति लंबी हो जाती है, जो सूजन, कब्ज, दस्त के साथ बारी-बारी से प्रकट हो सकती है। दस्त) इसके अलावा, आंतों की दीवारों तक रक्त पहुंचाने वाली वाहिकाओं को निचोड़ते समय, उनका परिगलन विकसित हो सकता है ( ऊतक मृत्यु) इससे तीव्र आंतों में रुकावट होगी, जिसके लिए तत्काल सर्जिकल हस्तक्षेप की आवश्यकता होगी।
- हार तंत्रिका प्रणाली. लिम्फोग्रानुलोमैटोसिस में काफी दुर्लभ घटना। यह मुख्य रूप से बढ़े हुए लिम्फ नोड्स द्वारा रीढ़ की हड्डी के संपीड़न के कारण होता है, जिससे शरीर के कुछ क्षेत्रों में बिगड़ा संवेदनशीलता और मोटर गतिविधि हो सकती है ( अधिक बार पैरों, बाहों में).
- गुर्दे खराब।काठ का क्षेत्र के लिम्फ नोड्स में वृद्धि और वृक्क ऊतक के संपीड़न के कारण हॉजकिन के लिंफोमा का एक दुर्लभ लक्षण भी है। यदि एक गुर्दा प्रभावित होता है, तो कोई नैदानिक अभिव्यक्तियाँ नहीं हो सकती हैं, क्योंकि दूसरा सामान्य रूप से कार्य करेगा। लिम्फ नोड्स के स्पष्ट द्विपक्षीय प्रसार के साथ, दोनों अंग प्रभावित हो सकते हैं, जिससे गुर्दे की विफलता का विकास होगा।
आंतरिक अंगों को नुकसान के कारण लक्षण
किसी भी ट्यूमर रोग की तरह, हॉजकिन के लिंफोमा में मेटास्टेसिस होने का खतरा होता है, यानी शरीर के किसी भी ऊतक में ट्यूमर कोशिकाओं के प्रवास के लिए ( ऊपर वर्णित रोग संबंधी प्रतिक्रियाओं के विकास और ग्रैनुलोमा के गठन के साथ).आंतरिक अंगों को नुकसान के लक्षण हो सकते हैं:
- जिगर इज़ाफ़ा ( हिपेटोमिगेली). आधे से अधिक रोगियों में इस अंग की हार देखी जाती है। यकृत में रोग प्रक्रियाओं के विकास से इसके आकार में वृद्धि होती है। बढ़ते ग्रेन्युलोमा धीरे-धीरे सामान्य यकृत कोशिकाओं को बाहर निकाल देते हैं, जिससे सभी अंग कार्यों में व्यवधान होता है।
- तिल्ली का बढ़ना ( तिल्ली का बढ़ना). यह लक्षण लिम्फोग्रानुलोमैटोसिस वाले लगभग 30% रोगियों में होता है और रोग के बाद के चरणों के लिए विशिष्ट है। बढ़ी हुई प्लीहा सख्त, दर्द रहित होती है और आमतौर पर रोगी को कोई असुविधा नहीं होती है।
- अस्थि मज्जा में हेमटोपोइजिस का उल्लंघन।जब अस्थि गुहाओं को ट्यूमर कोशिकाओं द्वारा उपनिवेशित किया जाता है, तो लाल अस्थि मज्जा के सामान्य ऊतक का क्रमिक विस्थापन हो सकता है, जिससे इसके हेमटोपोइएटिक फ़ंक्शन का उल्लंघन होगा। नतीजा यह प्रोसेसअप्लास्टिक एनीमिया का विकास हो सकता है, जो रक्त के सभी सेलुलर तत्वों की संख्या में कमी की विशेषता है।
- कंकाल प्रणाली को नुकसान।अस्थि मज्जा के हेमटोपोइएटिक फ़ंक्शन को बाधित करने के अलावा, ट्यूमर मेटास्टेस से हड्डी के ऊतकों को ही नुकसान हो सकता है। नतीजतन, हड्डियों की संरचना और ताकत परेशान होती है, जो प्रभावित क्षेत्र में दर्द और पैथोलॉजिकल फ्रैक्चर से प्रकट हो सकती है ( न्यूनतम भार की कार्रवाई के तहत उत्पन्न होना) कशेरुक शरीर, उरोस्थि, पैल्विक हड्डियां सबसे अधिक बार प्रभावित होती हैं, शायद ही कभी पसलियां, हाथ और पैरों की लंबी ट्यूबलर हड्डियां।
- फेफड़े की क्षति।यह 10-15% मामलों में नोट किया जाता है और अक्सर बढ़े हुए लिम्फ नोड्स से रोग प्रक्रिया के अंकुरण के कारण होता है। एक नियम के रूप में, सबसे पहले यह किसी भी लक्षण के साथ नहीं है। रोग के बाद के चरणों में, फेफड़े के ऊतकों को भारी नुकसान के साथ, सांस की तकलीफ, खांसी और श्वसन विफलता की अन्य अभिव्यक्तियाँ दिखाई दे सकती हैं।
- त्वचा की खुजली।यह लक्षण सभी लिम्फ नोड्स और अन्य अंगों में ल्यूकोसाइट्स की संख्या में वृद्धि के कारण होता है। जब ये कोशिकाएं नष्ट हो जाती हैं, तो इनमें से कई जैविक रूप से सक्रिय पदार्थ निकलते हैं, जिनमें से कुछ ( हिस्टामिन) त्वचा के एक निश्चित क्षेत्र में जलन और दर्द होता है। रोग के बाद के चरणों में, खुजली रक्त में बिलीरुबिन की सांद्रता में वृद्धि के कारण भी हो सकती है ( तब होता है जब जिगर से पित्त के प्रवाह में रुकावट होती है).
उपरोक्त अभिव्यक्तियों के आधार पर ( और रोगी की सावधानीपूर्वक जांच के बाद) रोग के 4 चरणों को अलग करें, जो प्रभावित लिम्फ नोड्स या अन्य आंतरिक अंगों की संख्या से निर्धारित होते हैं। उपचार के सही नुस्खे और इसके परिणामों की भविष्यवाणी के लिए लिम्फोग्रानुलोमैटोसिस के चरण का निर्धारण अत्यंत महत्वपूर्ण है।
ट्यूमर प्रक्रिया की व्यापकता की डिग्री के आधार पर, निम्न हैं:
- मैं मंच।यह लिम्फ नोड्स के एक समूह या एक गैर-लिम्फोइड अंग की हार की विशेषता है ( जिगर, फेफड़े और इतने पर) इस स्तर पर, रोग की नैदानिक अभिव्यक्तियाँ लगभग हमेशा अनुपस्थित होती हैं, और बढ़े हुए लिम्फ नोड्स एक निवारक परीक्षा के दौरान एक आकस्मिक खोज बन सकते हैं।
- द्वितीय चरण।डायाफ्राम के ऊपर या नीचे लिम्फ नोड्स के कई समूह प्रभावित होते हैं ( श्वसन पेशी जो छाती को उदर अंगों से अलग करती है), साथ ही गैर-लिम्फोइड अंगों में ग्रैनुलोमा। रोग की नैदानिक अभिव्यक्तियाँ पहले चरण की तुलना में अधिक सामान्य हैं।
- तृतीय चरण।डायाफ्राम के दोनों किनारों पर लिम्फ नोड्स के कई समूहों में वृद्धि के साथ-साथ विभिन्न अंगों और ऊतकों में कई ग्रेन्युलोमा की उपस्थिति की विशेषता है। चरण III में अधिकांश रोगियों में, प्लीहा, यकृत और अस्थि मज्जा प्रभावित होते हैं।
- छठा चरण।यह एक या एक से अधिक आंतरिक अंगों या ऊतकों को उनकी संरचना और कार्य के स्पष्ट उल्लंघन के साथ क्षति की विशेषता है। इस स्तर पर लिम्फ नोड्स में वृद्धि आधे मामलों में निर्धारित होती है।
रोग की प्रणालीगत अभिव्यक्तियाँ
लिम्फोग्रानुलोमैटोसिस, सभी ट्यूमर रोगों की तरह, अनुकूली प्रतिक्रियाओं के उल्लंघन और शरीर की एक सामान्य कमी की ओर जाता है, जो कई लक्षणों की विशेषता है।लिम्फोग्रानुलोमैटोसिस की प्रणालीगत अभिव्यक्तियाँ हो सकती हैं:
- शरीर के तापमान में वृद्धि।यह रोग की सबसे विशिष्ट अभिव्यक्तियों में से एक है। आमतौर पर तापमान में 38 - 40ºС तक की लहर जैसी वृद्धि होती है, जिसके साथ मांसपेशियों में दर्द, ठंड लगना ( ठंड लगना और कंपकंपी महसूस होना) और कई घंटों तक चल सकता है। तापमान में कमी काफी जल्दी होती है और हमेशा अत्यधिक पसीने के साथ होती है। आमतौर पर, हर कुछ दिनों में बुखार के लक्षण दर्ज किए जाते हैं, हालांकि, जैसे-जैसे बीमारी बढ़ती है, उनके बीच का अंतराल छोटा होता जाता है।
- कमजोरी और थकान।ये लक्षण आमतौर पर रोग के III-IV चरणों में प्रकट होते हैं। उनकी घटना सीधे ट्यूमर कोशिकाओं की वृद्धि और विकास दोनों के कारण होती है ( जो शरीर के भंडार से बड़ी मात्रा में पोषक तत्वों का उपभोग करते हैं) और सक्रियण ( इसके बाद थकावट) ट्यूमर से लड़ने के उद्देश्य से शरीर की रक्षा प्रणाली। रोगी सुस्त होते हैं, लगातार नींद में होते हैं, किसी भी शारीरिक गतिविधि को बर्दाश्त नहीं करते हैं, ध्यान की एकाग्रता अक्सर परेशान होती है।
- वजन घटना. पैथोलॉजिकल एक व्यक्ति के वजन में 6 महीने में प्रारंभिक शरीर के वजन के 10% से अधिक की कमी है। यह स्थिति लिम्फोग्रानुलोमैटोसिस के टर्मिनल चरणों के लिए विशिष्ट है, जब शरीर समाप्त हो जाता है और कई आंतरिक अंग विफल हो जाते हैं। सबसे पहले, हाथ और पैरों में चमड़े के नीचे की चर्बी गायब हो जाती है, फिर पेट, चेहरे और पीठ में। टर्मिनल चरणों में, कमी होती है मांसपेशियों. सामान्य कमजोरी बढ़ जाती है, आत्म-सेवा की क्षमता के पूर्ण नुकसान तक। शरीर की आरक्षित प्रणालियों का ह्रास और आंतरिक अंगों की बढ़ती कार्यात्मक अपर्याप्तता से रोगी की मृत्यु हो सकती है।
- बार-बार संक्रमण।प्रतिरक्षा प्रणाली के उल्लंघन के साथ-साथ सुरक्षात्मक भंडार की सामान्य कमी के कारण, मानव शरीर विभिन्न प्रकार के रोगजनक सूक्ष्मजीवों के खिलाफ रक्षाहीन है। वातावरण. कीमोथेरेपी और रेडियोथेरेपी के उपयोग से यह स्थिति बढ़ जाती है ( रोग के उपचार में प्रयोग किया जाता है) लिम्फोग्रानुलोमैटोसिस के साथ, वायरल रोग विकसित हो सकते हैं ( हर्पीस ज़ोस्टर वायरस के कारण होने वाला चिकनपॉक्स), कवक ( कैंडिडिआसिस, क्रिप्टोकोकल मेनिन्जाइटिस) और जीवाणु संक्रमण ( निमोनिया और अन्य).
लिम्फोग्रानुलोमैटोसिस का निदान
 हॉजकिन के लिंफोमा का निदान एक जटिल प्रक्रिया है, जो रोग के अधिकांश लक्षणों की गैर-विशिष्टता से जुड़ी है। यह देर से निदान और उपचार की देरी से शुरू होने का कारण है, जो रोग के अंतिम चरण में हमेशा प्रभावी नहीं होता है।
हॉजकिन के लिंफोमा का निदान एक जटिल प्रक्रिया है, जो रोग के अधिकांश लक्षणों की गैर-विशिष्टता से जुड़ी है। यह देर से निदान और उपचार की देरी से शुरू होने का कारण है, जो रोग के अंतिम चरण में हमेशा प्रभावी नहीं होता है। लिम्फोग्रानुलोमैटोसिस का निदान और उपचार रुधिर विज्ञान विभाग के एक अस्पताल में किया जाता है। रोग के लक्षणों की गहन जांच के अलावा, एक हेमेटोलॉजिस्ट निदान की पुष्टि या खंडन करने के लिए कई अतिरिक्त प्रयोगशाला और वाद्य अध्ययन लिख सकता है।
लिम्फोग्रानुलोमैटोसिस के निदान में, निम्नलिखित का उपयोग किया जाता है:
- परीक्षा के वाद्य तरीके;
- अस्थि मज्जा पंचर;
- लिम्फ नोड्स की हिस्टोलॉजिकल परीक्षा;
- लिम्फोसाइटों का इम्यूनोफेनोटाइपिंग।
सामान्य रक्त विश्लेषण ( यूएसी)
यह अध्ययन आपको परिधीय रक्त की संरचना में परिवर्तनों को जल्दी और सटीक रूप से निर्धारित करने की अनुमति देता है, जो ट्यूमर प्रक्रिया और इसकी जटिलताओं दोनों के कारण हो सकता है। रोगी के रक्त की कोशिकीय संरचना का विश्लेषण किया जाता है, प्रत्येक प्रकार की कोशिका का आकार और आकार, उनका प्रतिशत.यह ध्यान रखना महत्वपूर्ण है कि परिधीय रक्त में लिम्फोग्रानुलोमैटोसिस में कोई विशिष्ट परिवर्तन नहीं होते हैं जो इस बीमारी के निदान की पुष्टि करने की अनुमति देते हैं, इसलिए ओएसी मुख्य रूप से शरीर के विभिन्न अंगों और प्रणालियों की कार्यात्मक स्थिति निर्धारित करने के लिए निर्धारित किया जाता है।
रक्त लेने की प्रक्रिया
बायोमटेरियल को सुबह खाली पेट लिया जाता है। विश्लेषण के लिए रक्तदान करने से पहले भारी मात्रा में रक्तदान से बचना जरूरी है शारीरिक गतिविधि, धूम्रपान और शराब पीना। यदि संभव हो तो, किसी भी दवा के इंट्रामस्क्युलर प्रशासन को बाहर रखा जाना चाहिए।
सामान्य विश्लेषण के लिए इस्तेमाल किया जा सकता है:
- केशिका रक्त ( एक उंगली से);
- ऑक्सीजन - रहित खून।
- बाँझ दस्ताने में एक नर्स इंजेक्शन साइट को 70% अल्कोहल के घोल में डूबा हुआ कपास की गेंद से दो बार उपचारित करती है ( संक्रमण को रोकने के लिए).
- उंगलियों की पार्श्व सतह पर त्वचा को पंचर करने के लिए एक विशेष सुई-स्कारिफायर का उपयोग किया जाता है ( जहां केशिका नेटवर्क अधिक विकसित होता है).
- सूखे रुई के फाहे से खून की पहली बूंद को हटा दिया जाता है।
- स्नातक में ग्लास ट्यूबआवश्यक मात्रा में रक्त एकत्र किया जाता है ( ट्यूब को घाव की सतह को नहीं छूना चाहिए).
- रक्त के नमूने के बाद, एक साफ कपास की गेंद, जिसे शराब से भी सिक्त किया जाता है, इंजेक्शन स्थल पर लगाया जाता है ( 2 - 3 मिनट के लिए).
- रोगी एक कुर्सी पर बैठता है और अपना हाथ अपनी पीठ पर रखता है ताकि कोहनी का जोड़ सबसे विस्तारित स्थिति में हो।
- कोहनी क्षेत्र से 10-15 सेमी ऊपर एक रबर टूर्निकेट लगाया जाता है ( यह नसों को रक्त से भरने में योगदान देता है और प्रक्रिया को सुविधाजनक बनाता है).
- नर्स उस नस का स्थान निर्धारित करती है जिससे रक्त लिया जाएगा।
- इंजेक्शन साइट को 70% अल्कोहल के घोल में भिगोए हुए कॉटन बॉल से दो बार उपचारित किया जाता है।
- एक डिस्पोजेबल सिरिंज का उपयोग त्वचा और सफ़ीन नस को पंचर करने के लिए किया जाता है। सुई त्वचा की सतह से लगभग 30º के कोण पर होनी चाहिए, इसके बिंदु को कंधे की ओर निर्देशित किया जाना चाहिए ( सुई का यह सम्मिलन प्रक्रिया के बाद नस में रक्त के थक्कों को बनने से रोकता है).
- सुई के नस में होने के बाद, नर्स तुरंत टूर्निकेट को हटा देती है और धीरे-धीरे सिरिंज के प्लंजर को वापस ले लेती है, कुछ मिलीलीटर शिरापरक रक्त खींचती है ( गहरा चेरी रंग).
- बाड़ के बाद आवश्यक राशिइंजेक्शन स्थल पर त्वचा पर रक्त को अल्कोहल कॉटन स्वैब से दबाया जाता है, और सुई को हटा दिया जाता है।
- रोगी को कोहनी पर हाथ मोड़ने के लिए कहा जाता है ( यह रक्तस्राव को रोकने में मदद करता है) और 10-15 मिनट के लिए दालान में बैठें, क्योंकि प्रक्रिया के बाद चक्कर आना संभव है।
परिणामी रक्त की कुछ बूंदों को एक कांच की स्लाइड में स्थानांतरित किया जाता है, विशेष रंगों से सना हुआ होता है और एक माइक्रोस्कोप के तहत जांच की जाती है। यह आपको कोशिकाओं के आकार और आकार को निर्धारित करने की अनुमति देता है। बायोमटेरियल का एक और हिस्सा एक विशेष हेमेटोलॉजिकल विश्लेषक में रखा गया है ( ये उपकरण अधिकांश आधुनिक प्रयोगशालाओं में उपलब्ध हैं), जो स्वचालित रूप से मात्रात्मक और . निर्धारित करता है गुणात्मक रचनारक्त परीक्षण किया।
लिम्फोग्रानुलोमैटोसिस में रक्त की सूक्ष्म जांच बिना सूचना के होती है। अत्यंत दुर्लभ मामलों में परिधीय रक्त स्मीयर में ट्यूमर कोशिकाओं की पहचान करना संभव है।
में परिवर्तन सामान्य विश्लेषणलिम्फोग्रानुलोमैटोसिस के साथ रक्त
| शोधित संकेतक | क्या करता है | आदर्श | लिम्फोग्रानुलोमैटोसिस में संभावित परिवर्तन |
| आरबीसी गिनती
(आरबीसी) | लाल रक्त कोशिकाओं की संख्या में कमी ( रक्ताल्पतालाल अस्थि मज्जा के मेटास्टेटिक घावों के परिणामस्वरूप रोग के III-IV चरणों में देखा जा सकता है। एनीमिया का एक अन्य कारण हॉजकिन रोग के उपचार में प्रयुक्त विकिरण और कीमोथेरेपी हो सकता है। | पुरुषों
(एम
)
:
4.0 - 5.0 x 10 12 / एल। | सामान्य या कम। |
| औरत(तथा):
3.5 - 4.7 x 10 12 / एल। |
|||
| कुल हीमोग्लोबिन स्तर (एचजीबी) | हीमोग्लोबिन एक विशेष प्रोटीन-वर्णक परिसर है जो लाल रक्त कोशिकाओं का हिस्सा है और शरीर में ऑक्सीजन परिवहन प्रदान करता है। लाल रक्त कोशिकाओं की कुल संख्या में कमी के साथ ही हीमोग्लोबिन एकाग्रता में कमी देखी जा सकती है। | एम: 130 - 170 ग्राम/ली. | सामान्य या कम। |
| तथा: 120 - 150 ग्राम/ली. | |||
| रेटिकुलोसाइट गिनती
( आरईटी) | रेटिकुलोसाइट्स लाल रक्त कोशिकाओं के युवा रूप हैं जो हेमटोपोइजिस की प्रक्रिया के दौरान अस्थि मज्जा में बनते हैं। रक्तप्रवाह में प्रवेश करने के बाद, वे अंततः 24 घंटों के भीतर परिपक्व हो जाते हैं, परिपक्व लाल रक्त कोशिकाओं में बदल जाते हैं। यदि अस्थि मज्जा में हेमटोपोइजिस की प्रक्रिया बाधित होती है, तो रक्त में इन कोशिकाओं की संख्या कम हो सकती है। | एम: 0,24 - 1,7%. | सामान्य या कुछ हद तक कम। |
| तथा: 0,12 - 2,05%. | |||
| प्लेटलेट गिनती (पठार) | प्लेटलेट्स, अन्य रक्त कोशिकाओं की तरह, लाल अस्थि मज्जा में बनते हैं, इसलिए, रोग के बाद के चरणों में, रक्त में उनकी एकाग्रता भी कम हो सकती है। | 180 - 320 x 10 9 / एल। | सामान्य या कम। |
| कुल सफेद रक्त कोशिका गिनती (डब्ल्यूबीसी) | ल्यूकोसाइट्स की कुल संख्या में वृद्धि पहले से ही रोग के दूसरे चरण में देखी जा सकती है। हालाँकि, यह संकेतक अपने आप में बहुत जानकारीपूर्ण नहीं है, इसलिए, विस्तृत का आकलन ल्यूकोसाइट सूत्र, जो व्यक्तिगत प्रकार के ल्यूकोसाइट्स का प्रतिशत प्रदर्शित करता है। | 4.0 - 9.0 x 10 9 / एल। | 4.0 x 10 9 / एल से अधिक। |
| बेसोफिल की संख्या (बी ० ए) | बेसोफिल ट्यूमर कोशिकाओं की ओर पलायन करते हैं और जैविक रूप से सक्रिय पदार्थों का स्राव करते हैं, इस प्रकार भड़काऊ प्रक्रिया का समर्थन करते हैं। | 0 - 1%. | 1% से अधिक। |
| ईोसिनोफिल्स की संख्या (ईओ) | ईोसिनोफिल कैंसर कोशिकाओं के विनाश के साथ-साथ विभिन्न विषाक्त पदार्थों के शरीर को साफ करने की प्रक्रिया में शामिल हैं। लिम्फोग्रानुलोमैटोसिस के साथ, रोग के बढ़ने पर ईोसिनोफिल की संख्या बढ़ जाती है, विशेष रूप से प्रणालीगत अभिव्यक्तियों की उपस्थिति में। | 0,5 - 5%. | 5% से अधिक। |
| न्यूट्रोफिल की संख्या
(न्यूट) | ट्यूमर प्रक्रिया सीधे न्यूट्रोफिलिया की ओर नहीं ले जाती है ( रक्त में न्यूट्रोफिल की संख्या में वृद्धि) इन कोशिकाओं की सांद्रता रोग के बाद के चरणों में बढ़ सकती है, जब शरीर के सुरक्षात्मक कार्य बाधित होते हैं और विभिन्न संक्रमण जुड़ते हैं। | खंडित रूप: | रोग के III-IV चरणों में वृद्धि। अक्सर छुरा रूपों के प्रतिशत में वृद्धि होती है ( ल्यूकोसाइट सूत्र को बाईं ओर शिफ्ट करना). |
| बैंड के रूप: | |||
| मोनोसाइट्स की संख्या (सोमवार) | मोनोसाइट्स ( ऊतक मैक्रोफेज में बदलना) सीधे ग्रेन्युलोमा के निर्माण में शामिल होते हैं, इसलिए रक्त में उनकी एकाग्रता शरीर में ट्यूमर प्रक्रिया की गंभीरता और व्यापकता पर निर्भर करेगी। | 3 - 11%. | मानक से काफी ऊपर। |
| लिम्फोसाइटों की संख्या
(लाइम) | लिम्फोग्रानुलोमैटोसिस में कमी की विशेषता है कुल गणनापरिधीय रक्त में लिम्फोसाइट्स। इसके कारण हो सकते हैं:
| 19 - 37%. | महत्वपूर्ण रूप से कम हो गया, विशेष रूप से बीमारी के लंबे पाठ्यक्रम के साथ। |
| एरिथ्रोसाइट्स की अवसादन दर (ईएसआर) | एरिथ्रोसाइट अवसादन दर एक टेस्ट ट्यूब में रखे रक्त को दो परतों में अलग होने में लगने वाला समय है - शीर्ष ( प्लाज्मा) और निचला ( सेलुलर तत्व). सामान्य परिस्थितियों में, लाल रक्त कोशिकाओं की बाहरी सतह पर ऋणात्मक आवेश होते हैं, जिसके परिणामस्वरूप वे एक दूसरे को प्रतिकर्षित करते हैं। लिम्फोग्रानुलोमैटोसिस के साथ, रक्त में कुछ पदार्थों की एकाग्रता बढ़ जाती है - सूजन के तीव्र चरण के तथाकथित प्रोटीन ( फाइब्रिनोजेन, सी-रिएक्टिव प्रोटीन, इम्युनोग्लोबुलिन और अन्य), जो ग्लूइंग एरिथ्रोसाइट्स और ट्यूब के नीचे उनके बसने की प्रक्रिया को तेज करता है। | एम: 3 - 10 मिमी / घंटा। | 15 मिमी / घंटा से अधिक। |
| तथा: 5 - 15 मिमी / घंटा। | 20 मिमी / घंटा से अधिक। |
एक पूर्ण रक्त गणना भी आमतौर पर हेमटोक्रिट निर्धारित करती है ( रक्त की कुल मात्रा में सेलुलर तत्वों के अनुपात को प्रदर्शित करना) और रंग सूचकांक ( हीमोग्लोबिन के साथ एरिथ्रोसाइट्स की संतृप्ति की विशेषता) लिम्फोग्रानुलोमैटोसिस के साथ, ये संकेतक सूचनात्मक नहीं हैं। उनकी परिभाषा का उपयोग सहवर्ती रोगों और जटिलताओं के निदान के लिए किया जाता है।
रक्त रसायन
अधिकांश रोगों के परिणामस्वरूप रक्त में कुछ पदार्थों की सांद्रता में वृद्धि होती है ( प्रोटीन, एंजाइम और अन्य) उनके स्तर का निर्धारण करने से स्वयं रोग का निदान करने में मदद मिलती है, साथ ही आंतरिक अंगों और प्रणालियों की स्थिति का आकलन करने में भी मदद मिलती है।लिम्फोग्रानुलोमैटोसिस के लिए सबसे अधिक जानकारीपूर्ण जैव रासायनिक संकेतक हैं:
- सूजन के तीव्र चरण के प्रोटीन;
- जिगर परीक्षण।
शरीर में एक भड़काऊ प्रक्रिया का पहला संकेत रक्त में तीव्र चरण प्रोटीन की उपस्थिति है। ये पदार्थ यकृत में, साथ ही मोनोसाइट्स, न्यूट्रोफिल और लिम्फोसाइटों में बनते हैं। वे सूजन के केंद्र में रक्त परिसंचरण में सुधार करते हैं और ल्यूकोसाइट्स की सक्रियता में योगदान करते हैं, जिससे शरीर के सुरक्षात्मक गुणों में वृद्धि होती है। इसके अलावा, ये प्रोटीन कोशिका क्षय के दौरान बनने वाले विभिन्न विषाक्त पदार्थों को बेअसर करते हैं और स्वस्थ ऊतकों को नुकसान से बचाते हैं।
लिम्फोग्रानुलोमैटोसिस में तीव्र चरण प्रोटीन का पता चला
लिम्फोग्रानुलोमैटोसिस के साथ, सभी लिम्फ नोड्स और अन्य अंगों में सूजन विकसित होती है जिसमें ट्यूमर कोशिकाएं पलायन करती हैं। इस मामले में, तीव्र चरण प्रोटीन की एकाग्रता दसियों या सैकड़ों गुना तक बढ़ सकती है, जो शरीर में भड़काऊ प्रक्रियाओं की गंभीरता को इंगित करती है और एक प्रतिकूल रोगसूचक संकेत है।
जिगर परीक्षण
यह शब्द परीक्षणों के एक समूह को जोड़ता है जो आपको यकृत की कार्यात्मक क्षमताओं का मूल्यांकन करने की अनुमति देता है। अधिकांश प्रोटीन यकृत में बनते हैं, विभिन्न विषाक्त पदार्थ निष्प्रभावी हो जाते हैं और शरीर के सामान्य कामकाज के लिए आवश्यक कई अन्य प्रतिक्रियाएं होती हैं। हॉजकिन के लिंफोमा में गंभीर जिगर की क्षति एक प्रतिकूल रोगसूचक संकेत है।
हॉजकिन रोग के लिए लीवर परीक्षण
| अनुक्रमणिका | क्या करता है | आदर्श | लिम्फोग्रानुलोमैटोसिस में परिवर्तन |
| कुल बिलीरुबिन स्तर | बिलीरुबिन एक वर्णक है पीला रंगतिल्ली में लाल रक्त कोशिकाओं के विनाश के दौरान हीमोग्लोबिन से बनता है। प्रारंभ में, मुक्त या अनबाउंड बिलीरुबिन बनता है, जिसे यकृत में स्थानांतरित किया जाता है, जहां यह ग्लुकुरोनिक एसिड से बांधता है - बिलीरुबिन का एक बाध्य अंश बनता है। इस रूप में, यह पित्त की संरचना में शामिल होता है, जो विशेष पित्त नलिकाओं के माध्यम से आंतों में प्रवेश करता है। बिलीरुबिन के समग्र स्तर में वृद्धि एरिथ्रोसाइट्स के बढ़ते विनाश और यकृत या पित्त पथ के विकृति दोनों के कारण हो सकती है, इसलिए इसके प्रत्येक अंश को अलग से निर्धारित करना आवश्यक है। | 8.5 - 20.5 µmol/ली. | आमतौर पर रोग के III-IV चरणों में बढ़ जाता है। |
| बिलीरुबिन का अनबाउंड अंश | लिम्फोग्रानुलोमैटोसिस के साथ, रक्त में बिलीरुबिन के अनबाउंड अंश की एकाग्रता में वृद्धि यकृत में ट्यूमर मेटास्टेस की उपस्थिति को इंगित करती है। इसी समय, अंग में कई ग्रेन्युलोमा विकसित होते हैं, जो सामान्य यकृत ऊतक को विस्थापित करते हैं, जिससे इसकी बाध्यकारी क्षमता में कमी आती है। | 4.5 - 17.1 µmol/ली. | 20 μmol / l से अधिक। |
| बिलीरुबिन बाध्य अंश | जिगर से पित्त के बहिर्वाह में रुकावट की उपस्थिति में इस अंश का स्तर बढ़ जाता है। इस मामले में, बिलीरुबिन ग्लुकुरोनिक एसिड से बांधता है, लेकिन इसे शरीर से निकालना असंभव है, जिसके परिणामस्वरूप बाध्य बिलीरुबिन रक्तप्रवाह में प्रवेश करना शुरू कर देता है। | 0.86 - 5.1 µmol/ली. | यह सामान्य से कई गुना ज्यादा हो सकता है। |
| एलानिन एमिनोट्रांस्फरेज़ स्तर(अलएटी)और एस्पार्टेट एमिनोट्रांस्फरेज़(पर जैसा) | एएलटी और एएसटी यकृत कोशिकाओं में पाए जाते हैं ( और कुछ अन्य अंग) और रक्त में तभी प्रवेश करते हैं जब वे नष्ट हो जाते हैं। भड़काऊ प्रक्रियाओं के विकास और यकृत में ग्रेन्युलोमा के गठन से अंग की कोशिकाओं का बड़े पैमाने पर विनाश होता है, जिसके परिणामस्वरूप इन पदार्थों की एक बड़ी मात्रा रक्तप्रवाह में निकल जाती है। | एम: 41 यू / एल तक। | यह कई दसियों बार आदर्श से अधिक हो सकता है, जो यकृत में एक तीव्र सूजन प्रक्रिया का संकेत है। |
| तथा: 31 यू / एल तक। |
वाद्य अनुसंधान के तरीके
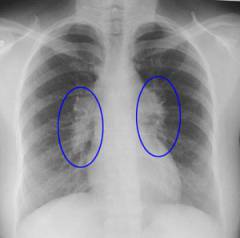 आधुनिक तकनीकट्यूमर प्रक्रिया की सीमा का आकलन करते हुए बढ़े हुए लिम्फ नोड्स, आंतरिक अंगों और ऊतकों को देखने की अनुमति दें, जो उपचार निर्धारित करने में महत्वपूर्ण भूमिका निभाता है।
आधुनिक तकनीकट्यूमर प्रक्रिया की सीमा का आकलन करते हुए बढ़े हुए लिम्फ नोड्स, आंतरिक अंगों और ऊतकों को देखने की अनुमति दें, जो उपचार निर्धारित करने में महत्वपूर्ण भूमिका निभाता है।
- सर्वेक्षण रेडियोग्राफी;
- अल्ट्रासाउंड प्रक्रिया;
- एंडोस्कोपिक अध्ययन।
यह सबसे सरल तरीका है जो आपको छाती और पेट में बढ़े हुए लिम्फ नोड्स के साथ-साथ आंतरिक अंगों की वृद्धि या संपीड़न की पहचान करने की अनुमति देता है।
विधि का सार इस प्रकार है - रोगी के एक तरफ एक एक्स-रे ट्यूब है, जो एक्स-रे का स्रोत है। मानव शरीर से गुजरने वाली ये किरणें ऊतकों और अंगों द्वारा आंशिक रूप से अवशोषित होती हैं, जिसके परिणामस्वरूप एक विशेष फिल्म पर उन सभी संरचनाओं की छाया छवि बनती है जिनसे वे गुजरे थे।
अस्थि ऊतक में विकिरण अवशोषण की अधिकतम डिग्री होती है, और हवा में न्यूनतम होती है। एक्स-रे पर बढ़े हुए लिम्फ नोड्स को ब्लैकआउट के फॉसी के रूप में परिभाषित किया गया है अनियमित आकारऔर विभिन्न आकार। वे विभिन्न अंगों को संकुचित और विस्थापित कर सकते हैं ( अन्नप्रणाली, श्वासनली, फेफड़े और अन्य), जिसे एक्स-रे पर देखा जा सकता है।
सीटी स्कैन ( सीटी)
यह विधि पर आधारित है एक्स-रे, साथ ही आधुनिक कंप्यूटर तकनीक. सीटी का सार इस प्रकार है - रोगी सीटी स्कैनर की एक विशेष वापस लेने योग्य टेबल पर लेट जाता है और उसे तंत्र के अंदर रखा जाता है। एक एक्स-रे ट्यूब और एक विशेष एक्स-रे रिसीवर इसके चारों ओर घूमना शुरू कर देता है, जिसके परिणामस्वरूप अध्ययन के तहत क्षेत्र की कई छवियां विभिन्न कोणों से ली जाती हैं।
प्राप्त जानकारी के कंप्यूटर प्रसंस्करण के बाद, डॉक्टर अध्ययन के तहत क्षेत्र की विस्तृत परत-दर-परत छवियां प्राप्त करता है, जिस पर लिम्फ नोड्स के प्रत्येक समूह के आकार, आंतरिक अंगों के आकार और आकार स्पष्ट रूप से भिन्न होते हैं।
अल्ट्रासाउंड प्रक्रिया ( अल्ट्रासाउंड)
यह विधिशरीर के ऊतकों की आंशिक रूप से प्रतिबिंबित करने की क्षमता के आधार पर ध्वनि तरंगे. विधि का सार इस प्रकार है - डिवाइस का एक विशेष सेंसर शरीर की सतह पर लगाया जाता है, जिसमें शामिल है विशेष क्रिस्टलपरिवर्तित करने में सक्षम वैद्युत संवेगध्वनि तरंगों में और, इसके विपरीत, ध्वनि तरंगों को बिजली में परिवर्तित करें।
प्रारंभ में, यह उपकरण शरीर के जांच किए गए क्षेत्र में फैलने वाली ध्वनि तरंगों के हिस्से का उत्सर्जन करता है। शरीर के ऊतकों में ध्वनि को प्रतिबिंबित करने की अलग-अलग क्षमता होती है, जिसके परिणामस्वरूप विभिन्न आवृत्ति और तीव्रता की ध्वनि तरंगें सेंसर में वापस आ जाती हैं। प्राप्त जानकारी को कंप्यूटर द्वारा संसाधित किया जाता है, और अध्ययन के तहत क्षेत्र में स्थित अंगों और संरचनाओं की एक छवि डिवाइस के मॉनिटर पर दिखाई देती है।
लिम्फोग्रानुलोमैटोसिस के साथ, अल्ट्रासाउंड आपको लिम्फ नोड्स के आकार और आकार की जांच करने, उनकी संरचना और घनत्व का मूल्यांकन करने की अनुमति देता है। इसके अलावा, यह विधि आंतरिक अंगों की जांच करना संभव बनाती है ( जिगर, प्लीहा), मेटास्टेस की उपस्थिति या अनुपस्थिति, उनकी संख्या निर्धारित करें।
अल्ट्रासाउंड का मुख्य लाभ उपयोग की गति और सुरक्षा है। आधुनिक उपकरण इतने कॉम्पैक्ट और उपयोग में आसान हैं कि अध्ययन डॉक्टर के कार्यालय में ही किया जा सकता है। प्रक्रिया में 10 - 20 मिनट से अधिक समय नहीं लगता है, जिसके बाद आप तुरंत परिणामों का विश्लेषण कर सकते हैं।
एंडोस्कोपिक तरीके
इस समूह में कई अध्ययन शामिल हैं, जिनका सिद्धांत एंडोस्कोप बनाए रखना है ( अंत में एक वीडियो कैमरा के साथ लंबी लचीली ट्यूब) विभिन्न अंगों और गुहाओं में। यह विधि आपको लिम्फ नोड्स के कुछ समूहों के विकास की डिग्री और आंतरिक अंगों के संपीड़न की गंभीरता का नेत्रहीन आकलन करने की अनुमति देती है।
लिम्फोग्रानुलोमैटोसिस के निदान में, निम्नलिखित का उपयोग किया जाता है:
- ब्रोंकोस्कोपी -मुंह के माध्यम से एंडोस्कोप की शुरूआत और श्वासनली, बड़ी और मध्यम ब्रांकाई की जांच।
- फाइब्रोगैस्ट्रोडोडोडेनोस्कोपी ( एफजीडीएस) - मुंह और परीक्षा के माध्यम से एक लंबे एंडोस्कोप का परिचय भीतरी सतहअन्नप्रणाली, पेट और ग्रहणी।
- कोलोनोस्कोपी -गुदा के माध्यम से एक एंडोस्कोप की शुरूआत और अंदर से बड़ी आंत की दीवारों की जांच।
- लैप्रोस्कोपी -पूर्वकाल पेट की दीवार में पंचर के माध्यम से एक एंडोस्कोप की शुरूआत और आंतरिक अंगों और पेट के लिम्फ नोड्स की जांच।
अस्थि मज्जा पंचर स्टर्नल पंचर)
इस अध्ययन में अस्थि मज्जा से हेमटोपोइएटिक ऊतक का एक टुकड़ा लेना और एक माइक्रोस्कोप के तहत इसकी जांच करना शामिल है। अध्ययन का उद्देश्य प्राप्त सामग्री में रीड-बेरेज़ोव्स्की-स्टर्नबर्ग ट्यूमर कोशिकाओं का पता लगाना है, साथ ही अस्थि मज्जा के हेमटोपोइएटिक फ़ंक्शन का आकलन करना है।सामग्री बाँझ परिस्थितियों में ली जाती है। पंचर एक विशेष सुई के साथ किया जाता है, जिस पर एक लिमिटर गार्ड होता है जो सुई को बहुत गहराई से डालने और आंतरिक अंगों को नुकसान पहुंचाने से रोकता है। प्रस्तावित पंचर की साइट ( आमतौर पर उरोस्थि के ऊपरी तिहाई) कीटाणुशोधन के उद्देश्य से, इसे 70% अल्कोहल और आयोडीन के घोल से दो बार उपचारित किया जाता है। उसके बाद, त्वचा और पेरीओस्टेम को 1 - 1.5 सेमी की गहराई तक पंचर किया जाता है। यह सुनिश्चित करने के बाद कि सुई हड्डी की गुहा में है, डॉक्टर धीरे-धीरे सिरिंज सवार को 2 - 4 मिलीलीटर अस्थि मज्जा लेकर वापस खींचना शुरू कर देता है।
प्रक्रिया के बाद, पंचर साइट को आयोडीन के घोल में भिगोकर एक बाँझ धुंध से ढक दिया जाता है और चिपकने वाली टेप से सील कर दिया जाता है। परिणामी सामग्री को प्रयोगशाला में भेजा जाता है, जहां इसकी सूक्ष्म जांच की जाती है।
इस बात पे ध्यान दिया जाना चाहिए कि ये पढाईसूचनात्मक केवल 10% मामलों में जब ट्यूमर हड्डी को मेटास्टेसाइज करता है, जिससे अस्थि मज्जा पदार्थ लिया जाता है। अन्य मामलों में, परिणाम नकारात्मक होगा।
लिम्फ नोड्स की हिस्टोलॉजिकल परीक्षा
 यह सबसे है सटीक तरीका, लगभग 100% मामलों में लिम्फोग्रानुलोमैटोसिस के निदान की पुष्टि करने की अनुमति देता है। विधि का सार एक या एक से अधिक लिम्फ नोड्स का आजीवन निष्कासन और उनकी सूक्ष्म परीक्षा है।
यह सबसे है सटीक तरीका, लगभग 100% मामलों में लिम्फोग्रानुलोमैटोसिस के निदान की पुष्टि करने की अनुमति देता है। विधि का सार एक या एक से अधिक लिम्फ नोड्स का आजीवन निष्कासन और उनकी सूक्ष्म परीक्षा है। लिम्फ नोड्स की बायोप्सी
सामग्री पिकअप ( बायोप्सी) आमतौर पर स्थानीय या सामान्य संज्ञाहरण के तहत एक बाँझ ऑपरेटिंग कमरे में किया जाता है।
सामग्री प्राप्त करने की तकनीक के आधार पर, निम्न हैं:
- सुई बायोप्सी।लिम्फ नोड्स के एक समूह को एक विशेष खोखली सुई से छेदा जाता है, और एक निश्चित संख्या में कोशिकाएं सुई में प्रवेश करती हैं।
- आकांक्षा बायोप्सी।लिम्फ नोड में एक पतली सुई डाली जाती है। इसके विपरीत छोर पर एक निर्वात निर्मित होता है ( एक विशेष उपकरण या एक पारंपरिक सिरिंज के साथ) सुई धीरे-धीरे पीछे हटने लगती है, जबकि लिम्फ नोड का ऊतक सिरिंज में चला जाता है।
- आकस्मिक बायोप्सी।लिम्फ नोड्स का एक समूह शल्य चिकित्सा द्वारा हटा दिया जाता है।
- एंडोस्कोपी के दौरान बायोप्सी।
प्राप्त सामग्री से अल्ट्राथिन खंड तैयार किए जाते हैं, जिन्हें विशेष रंगों से दागा जाता है और एक माइक्रोस्कोप के तहत जांच की जाती है। लिम्फोग्रानुलोमैटोसिस का प्रमाण बड़ी बहुराष्ट्रीय रीड-बेरेज़ोव्स्की-स्टर्नबर्ग कोशिकाओं और उनके युवा अग्रदूतों - हॉजकिन कोशिकाओं का पता लगाना है, साथ ही लिम्फ नोड की संरचना का उल्लंघन और इसमें विशिष्ट ग्रैनुलोमा की उपस्थिति है, जो एक संचय हैं एक बड़ी संख्या मेंट्यूमर कोशिकाओं के आसपास ल्यूकोसाइट्स।
प्रभावित लिम्फ नोड्स की ऊतकीय संरचना के आधार पर, हॉजकिन के लिंफोमा के 4 प्रकार प्रतिष्ठित हैं:
- क्लासिक ( लिम्फोहिस्टियोसाइटिक) विकल्प -लिम्फ नोड में लिम्फोसाइटों की प्रबलता द्वारा विशेषता।
- गांठदार काठिन्य -लिम्फ नोड को भेदने और इसकी संरचना का उल्लंघन करने वाले संयोजी ऊतक के किस्में के गठन की विशेषता है।
- मिश्रित सेल प्रकार -सभी प्रकार के ल्यूकोसाइट्स, फाइब्रोसिस और नेक्रोसिस के फॉसी की उपस्थिति की विशेषता है ( लिम्फ नोड ऊतक का स्थानीय परिगलन).
- लिम्फोइड कमी -रेशेदार ऊतक के साथ लिम्फ नोड्स के पूर्ण प्रतिस्थापन, बड़ी संख्या में ट्यूमर कोशिकाओं की उपस्थिति, साथ ही सामान्य लिम्फोसाइटों की कमी या पूर्ण अनुपस्थिति की विशेषता है।
लिम्फोसाइटों का इम्यूनोफेनोटाइपिंग
यह एक आधुनिक उच्च-सटीक शोध पद्धति है जो आपको अस्थि मज्जा या लिम्फ नोड के पंचर में रक्त में विभिन्न प्रकार के लिम्फोसाइटों को पहचानने और "पहचानने" की अनुमति देती है।शरीर की सभी कोशिकाओं की सतह पर एंटीजन नामक कुछ पदार्थों का एक समूह होता है। प्रत्येक सेल प्रकार के लिए ट्यूमर के लिए सहित) एंटीजन के एक कड़ाई से परिभाषित सेट की विशेषता है, जिसकी परिभाषा परीक्षण सामग्री में इन कोशिकाओं की उपस्थिति का न्याय करना संभव बनाती है।
लिम्फोग्रानुलोमैटोसिस के मार्कर सीडी 15 और सीडी 30 एंटीजन हैं, जो केवल ट्यूमर कोशिकाओं की सतह पर दिखाई देते हैं। उनका पता लगाना निम्नानुसार किया जाता है - परीक्षण सामग्री में विशेष एंटीबॉडी का एक सेट जोड़ा जाता है, जो केवल ट्यूमर एंटीजन के साथ बातचीत कर सकता है। ट्यूमर कोशिकाओं की उपस्थिति में ( और उनकी सतह पर संबंधित एंटीजन) एक मजबूत एंटीजन-एंटीबॉडी कॉम्प्लेक्स बनेगा।
एंटीबॉडी को एक विशेष पदार्थ के साथ पूर्व-लेबल किया जाता है, जो बाद में लेबल किए गए कोशिकाओं को गैर-लेबल वाले कोशिकाओं से अलग करना संभव बनाता है। अध्ययन के दूसरे चरण में प्रवाह साइटोमेट्री की विधि का उपयोग किया जाता है। परीक्षण सामग्री को एक विशेष उपकरण में रखा जाता है जो एक विशिष्ट लेबल की उपस्थिति या अनुपस्थिति के लिए प्रत्येक कोशिका की जांच करता है। आधुनिक प्रवाह साइटोमीटर प्रति सेकंड हजारों कोशिकाओं की जांच कर सकता है, जो आपको काफी कम समय में सटीक परिणाम प्राप्त करने की अनुमति देता है।
लिम्फोग्रानुलोमैटोसिस का उपचार
 इस रोग का उपचार अस्पताल के रुधिर विज्ञान विभाग में अनुभवी रुधिर विशेषज्ञों द्वारा किया जाना चाहिए। आज तक, हॉजकिन के लिंफोमा को एक इलाज योग्य बीमारी माना जाता है। समय पर निदान और पर्याप्त चिकित्सा के साथ, पूर्ण छूट प्राप्त की जा सकती है।
इस रोग का उपचार अस्पताल के रुधिर विज्ञान विभाग में अनुभवी रुधिर विशेषज्ञों द्वारा किया जाना चाहिए। आज तक, हॉजकिन के लिंफोमा को एक इलाज योग्य बीमारी माना जाता है। समय पर निदान और पर्याप्त चिकित्सा के साथ, पूर्ण छूट प्राप्त की जा सकती है। हॉजकिन रोग के उपचार में प्रयोग किया जाता है:
- रेडियोथेरेपी;
- चिकित्सा उपचार ( कीमोथेरपी);
- शल्य चिकित्सा।
रेडियोथेरेपी
लिम्फोग्रानुलोमैटोसिस के उपचार में विकिरण चिकित्सा का उपयोग 1902 से किया जा रहा है। इस पद्धति ने आज तक अपनी प्रभावशीलता नहीं खोई है।रेडियोथेरेपी का सार आयनकारी विकिरण का स्थानीय प्रभाव है ( गामा किरणें) प्रभावित लिम्फ नोड्स या अन्य ऊतकों के फोकस पर जिसमें ट्यूमर कोशिकाएं और विशिष्ट ग्रैनुलोमा होते हैं। विकिरण विकिरण, शरीर की जीवित कोशिकाओं से गुजरते हुए, आनुवंशिक तंत्र के स्तर पर क्षति का कारण बनता है ( कई डीएनए म्यूटेशन की ओर जाता है जो सेल के निरंतर अस्तित्व और प्रजनन के साथ असंगत हैं) रीड-बेरेज़ोव्स्की-स्टर्नबर्ग ट्यूमर कोशिकाएं और हॉजकिन कोशिकाएं इस प्रकार की चिकित्सा के प्रति बेहद संवेदनशील होती हैं, जिसके परिणामस्वरूप उनकी तेजी से मृत्यु का उल्लेख किया जाता है।
बहुत कुछ जाना जाता है विभिन्न विकल्पलिम्फोग्रानुलोमैटोसिस के लिए रेडियोथेरेपी, हालांकि, आज सबसे आम तरीका रेडिकल मेंटल विकिरण है, जिसका उपयोग रोग के चरण I-II में किया जाता है। इसका सार सबमांडिबुलर, सभी ग्रीवा और एक्सिलरी लिम्फ नोड्स, छाती के बढ़े हुए लिम्फ नोड्स, साथ ही आस-पास के क्षेत्रों और अंगों के एक साथ विकिरण में निहित है जिसमें ट्यूमर कोशिकाएं माइग्रेट हो सकती हैं।
संपूर्ण उपचार चक्र 4-5 सप्ताह है। विकिरण की कुल मात्रा 36 ग्रे है ( ग्रे - आयनकारी विकिरण की अवशोषित खुराक के लिए माप की एक इकाई) आमतौर पर 20 सत्र किए जाते हैं, जिनमें से प्रत्येक में रोगी को 180 सेंटीग्रे की खुराक मिलती है ( सीजीआई) बड़ी मात्रा में लिम्फ नोड्स के साथ, कुल खुराक को 44 Gy तक बढ़ाया जा सकता है।
लिम्फोग्रानुलोमैटोसिस के चरण III और IV में, जब ट्यूमर कोशिकाओं को पूरे शरीर में वितरित किया जाता है, तो अकेले रेडियोथेरेपी का उपयोग अनुचित और अप्रभावी होता है। इस मामले में, विकिरण और ड्रग थेरेपी का संयोजन किया जाता है।
चिकित्सा उपचार
लिम्फोग्रानुलोमैटोसिस के लिए कीमोथेरेपी का लक्ष्य विभाजन को रोकना और शरीर में सभी ट्यूमर कोशिकाओं को नष्ट करना है। यह विधि रोग के किसी भी रूप में सफलतापूर्वक प्रयोग की जाती है ( रेडियोथेरेपी के साथ संयोजन में).आज तक, कई कुशल योजनाएंलिम्फोग्रानुलोमैटोसिस का दवा उपचार, जो एंटीकैंसर दवाओं के विभिन्न संयोजनों का उपयोग करता है। औसतन, उपचार का कोर्स 14 - 30 दिनों तक रहता है, जिसके दौरान प्रत्येक औषधीय उत्पादएक निश्चित समय पर और एक निश्चित खुराक में निर्धारित।
हॉजकिन के लिंफोमा के लिए कीमोथेरेपी फिर से शुरू होती है
| योजनाएबीवीडी (इस्तेमाल की जाने वाली दवाओं के पहले अक्षरों से बना संक्षिप्त नाम) |
||
| दवा का नाम | चिकित्सीय क्रिया का तंत्र | खुराक और प्रशासन |
| एड्रियामाइसिन | एंटीट्यूमर प्रभाव वाली जीवाणुरोधी दवा। कार्रवाई का तंत्र ट्यूमर डीएनए को बांधना है ( साथ ही सामान्य) कोशिकाओं और न्यूक्लिक एसिड के संश्लेषण को रोकना, जिससे कोशिका विभाजन की प्रक्रिया असंभव हो जाती है। इसके अलावा, यह दवा मुक्त ऑक्सीजन कणों के निर्माण की ओर ले जाती है, जो कोशिका झिल्ली और सभी जीवों को नष्ट कर देती है, जिससे कोशिका मृत्यु हो जाती है। | अंतःशिरा रूप से, उपचार के पहले और 15वें दिनों में, 25 मिलीग्राम प्रति 1 की खुराक पर वर्ग मीटरमानव शरीर की सतह मिलीग्राम/एम2). |
| bleomycin | इस दवा का एंटीट्यूमर प्रभाव आनुवंशिक तंत्र के स्तर पर इसके हानिकारक प्रभाव के कारण होता है। यह डीएनए के विनाश की ओर ले जाता है, जिससे ट्यूमर कोशिकाओं के आगे विभाजन के लिए असंभव हो जाता है। | अंतःशिरा रूप से, पाठ्यक्रम के पहले और 15 वें दिन, 10 मिलीग्राम / मी 2 की खुराक पर। |
| विनब्लास्टाइन | यह दवा एक विशेष प्रोटीन ट्यूबुलिन के विनाश का कारण बनती है, जो कोशिका के आकार और उसके सामान्य कामकाज को बनाए रखने के लिए आवश्यक है। ट्यूबुलिन की अनुपस्थिति में, सामान्य कोशिका विभाजन असंभव है। | अंतःशिरा रूप से, पाठ्यक्रम के 1 और 15 दिनों में, 6 मिलीग्राम / मी 2 की खुराक पर। |
| डकारबाज़िन | एक साइटोस्टैटिक दवा जो कोशिका के नाभिक में न्यूक्लिक एसिड के संश्लेषण को रोकती है, कोशिका विभाजन की प्रक्रियाओं को रोकती है। | अंतःशिरा रूप से, पाठ्यक्रम के पहले और 15 वें दिन, 375 मिलीग्राम / मी 2 की खुराक पर। |
| योजनाबीकॉप | ||
| bleomycin | अंतःशिरा रूप से, पाठ्यक्रम के 8 वें दिन, 10 मिलीग्राम / मी 2 की खुराक पर। | |
| एटोपोसाइड | कोशिकाओं के केंद्रक में डीएनए के नष्ट होने के कारण कोशिका विभाजन की प्रक्रिया को रोकता है। | अंतःशिरा रूप से, पाठ्यक्रम के 1 से 3 दिनों तक, 200 मिलीग्राम / मी 2 की खुराक पर। |
| एड्रिब्लास्टिन (एड्रियामाइसिन) | कार्रवाई का तंत्र ऊपर वर्णित है। | अंतःशिरा रूप से, पाठ्यक्रम के पहले दिन, 25 मिलीग्राम / मी 2 की खुराक पर। |
| साईक्लोफॉस्फोमाईड | साइटोस्टैटिक दवा जो मुख्य रूप से ट्यूमर कोशिकाओं पर कार्य करती है। न्यूक्लिक एसिड के संश्लेषण का उल्लंघन करता है, प्रोटीन के गठन और कोशिका विभाजन को रोकता है। | अंतःशिरा रूप से, पाठ्यक्रम के पहले दिन, 650 मिलीग्राम / मी 2 की खुराक पर। |
| विन्क्रिस्टाईन | इस दवा का एंटीट्यूमर प्रभाव निम्न कारणों से होता है:
| अंतःशिरा रूप से, पाठ्यक्रम के 8 वें दिन, 1.5 - 2 मिलीग्राम / मी 2 की खुराक पर। |
| प्रोकार्बाज़िन | यह दवा मुख्य रूप से ट्यूमर कोशिकाओं में जमा होती है, ऑक्सीकरण करती है और विषाक्त पदार्थों में बदल जाती है - पेरोक्साइड रेडिकल्स, जो कोशिका झिल्ली और ऑर्गेनेल को नष्ट कर देते हैं। | अंदर, गोलियों के रूप में, पाठ्यक्रम के 1 से 7 दिनों तक। प्रति दिन 1 बार, 100 मिलीग्राम / मी 2 की खुराक पर लें। |
| प्रेडनिसोलोन | हार्मोनल दवा, जो शरीर की प्रतिरक्षा प्रणाली की गतिविधि को रोकता है, और इसमें एक विरोधी भड़काऊ प्रभाव भी होता है। लिम्फोग्रानुलोमैटोसिस के साथ, यह प्रभावित अंगों में सूजन को कम करने के लिए निर्धारित है, जिससे रोग की प्रणालीगत अभिव्यक्तियों का उन्मूलन होता है। | अंदर, गोलियों के रूप में, पाठ्यक्रम के 1 से 14 दिनों तक। प्रति दिन 1 बार 40 मिलीग्राम / मी 2 की खुराक पर लें। |
लिम्फोग्रानुलोमैटोसिस के चरण I और II में, रोग की प्रणालीगत अभिव्यक्तियों की अनुपस्थिति में, एबीवीडी के 2 पाठ्यक्रम आमतौर पर रेडियोथेरेपी के संयोजन में उपयोग किए जाते हैं। एक व्यापक ट्यूमर प्रक्रिया के साथ ( जो III - IV चरणों से मेल खाती है) कीमोथेरेपी के 8 चक्र ( योजनाओं में से एक के अनुसार) यह आमतौर पर लिम्फ नोड्स के आकार में महत्वपूर्ण कमी के परिणामस्वरूप होता है, जो तब रेडियोथेरेपी के संपर्क में आते हैं।
उपरोक्त उपचार के उचित कार्यान्वयन से हॉजकिन के लिंफोमा वाले अधिकांश रोगियों में एक स्थिर छूट मिलती है।
उपचार की प्रभावशीलता के संकेत हैं:
- रोग की प्रणालीगत अभिव्यक्तियों में कमी और गायब होना;
- लिम्फ नोड्स का सिकुड़ना नैदानिक रूप से और CT . द्वारा पुष्टि की गई);
- श्वसन, पाचन और शरीर की अन्य प्रणालियों के अशांत कार्यों का सामान्यीकरण;
- प्रभावित लिम्फ नोड्स के लगातार कई हिस्टोलॉजिकल अध्ययनों में ट्यूमर कोशिकाओं की अनुपस्थिति।
हॉजकिन की बीमारी में "मोक्ष की कीमोथेरेपी" ( योजना डीएचएपी)
| दवा का नाम | चिकित्सीय क्रिया का तंत्र | खुराक और प्रशासन |
| सिस्प्लैटिन | एक एंटीकैंसर दवा जो सेलुलर डीएनए की संरचना में एकीकृत होती है और इसे बदल देती है, जिससे न्यूक्लिक एसिड के गठन और कोशिका मृत्यु के लंबे समय तक अवरोध होता है। | अंतःशिरा, ड्रिप, 24 घंटे के भीतर। यह पाठ्यक्रम के पहले दिन 100 मिलीग्राम / मी 2 की खुराक पर निर्धारित है। |
| साइटाराबिन | दवा न्यूक्लिक एसिड की संरचना में शामिल है, उनके गठन की प्रक्रिया को बाधित करती है। | अंतःशिरा, ड्रिप, 3 घंटे के लिए। यह पाठ्यक्रम के पहले दिन दो बार, 12 घंटे के अंतराल के साथ, 2 ग्राम / मी 2 की खुराक पर निर्धारित किया जाता है ( कुल दैनिक खुराक - 4 ग्राम / मी 2). |
| डेक्सामेथासोन | क्रिया का तंत्र प्रेडनिसोलोन के समान है ( ऊपर वर्णित). | अंतःशिरा रूप से, पाठ्यक्रम के 1 से 4 दिनों तक, 40 मिलीग्राम / मी 2 की खुराक पर। |
के बाद भी उपचार दियासबसे प्रतिकूल परिणामों के साथ बीमारी की पुनरावृत्ति और आगे बढ़ने की एक उच्च संभावना है। इस संबंध में, एंटीकैंसर दवाओं की उच्चतम संभव खुराक का उपयोग करके कट्टरपंथी कीमोथेरेपी करने की सिफारिश की जाती है। इस उपचार का लक्ष्य ट्यूमर कोशिकाओं को नष्ट करना है जो दवाओं की पारंपरिक खुराक के लिए प्रतिरोधी हैं।
करीब खराब असररेडिकल कीमोथेरेपी शरीर में सभी हेमटोपोइएटिक कोशिकाओं की मृत्यु है, इसलिए इस तरह के उपचार का अनिवार्य अंतिम चरण एक दाता अस्थि मज्जा प्रत्यारोपण है।
शल्य चिकित्सा
लिम्फोग्रानुलोमैटोसिस का सर्जिकल उपचार बहुत ही दुर्लभ मामलों में निर्धारित किया जाता है जब कीमोथेरेपी और रेडियोथेरेपी अप्रभावी होती है। इनमें से अधिकांश उपचार उपशामक हैं ( रोगी की सामान्य स्थिति में सुधार करने के लिए किया जाता है, लेकिन अंतर्निहित बीमारी का इलाज नहीं करता है).शल्य चिकित्सा द्वारा, लिम्फ नोड्स के विशाल समूह को हटाया जा सकता है, जो पड़ोसी अंगों के कामकाज को संकुचित और बाधित करते हैं। बढ़े हुए प्लीहा को भी हटाया जा सकता है ( स्प्लेनेक्टोमी) और अन्य आंतरिक अंग, जिनमें से परिवर्तन अपरिवर्तनीय हो गए हैं और रोगी के जीवन के लिए सीधा खतरा पैदा करते हैं।
लिम्फोग्रानुलोमैटोसिस के लिए पूर्वानुमान
 लिम्फोग्रानुलोमैटोसिस ट्यूमर की बीमारियों में से एक है जिसे पूरी तरह से ठीक किया जा सकता है। यदि निदान समय पर किया जाता है और पर्याप्त और समय पर उपचार निर्धारित किया जाता है, तो रोग का निदान अनुकूल है - 80% से अधिक रोगी ठीक हो जाते हैं।
लिम्फोग्रानुलोमैटोसिस ट्यूमर की बीमारियों में से एक है जिसे पूरी तरह से ठीक किया जा सकता है। यदि निदान समय पर किया जाता है और पर्याप्त और समय पर उपचार निर्धारित किया जाता है, तो रोग का निदान अनुकूल है - 80% से अधिक रोगी ठीक हो जाते हैं। लिम्फोग्रानुलोमैटोसिस के लिए पूर्वानुमान के कारण है:
- रोग का चरण। I-II चरणों में निदान स्थापित करते समय और जटिल उपचार आयोजित करते समय ( कीमोथेरेपी + रेडियोथेरेपी) 90% से अधिक मामलों में पूर्ण छूट होती है। यदि उपचार III-IV चरणों में शुरू किया जाता है, तो रोग का निदान कम अनुकूल होता है - 80% रोगियों में छूट प्राप्त की जा सकती है।
- रोग का हिस्टोलॉजिकल रूप।लिम्फोहिस्टियोसाइटिक संस्करण के साथ और गांठदार काठिन्य के साथ, लिम्फ नोड्स की संरचना परेशान होती है, लेकिन उनकी पूर्ण या आंशिक वसूली संभव है। मिश्रित-कोशिका संस्करण के साथ, और विशेष रूप से लिम्फोइड की कमी के साथ, प्रभावित लिम्फ नोड्स में अपरिवर्तनीय परिवर्तन होते हैं, और शरीर में सामान्य लिम्फोसाइटों की संख्या कम हो जाती है, जो एक प्रतिकूल रोगसूचक संकेत है।
- आंतरिक अंगों और प्रणालियों को नुकसान।आंतरिक अंगों में मेटास्टेस की उपस्थिति में, उनकी संरचना और कार्य का उल्लंघन हो सकता है, जो अक्सर अपरिवर्तनीय होता है।
- रिलैप्स की उपस्थिति।रेडिकल कीमोथेरेपी के बाद, 10-30% रोगियों को कुछ महीनों या वर्षों के भीतर रोग की तीव्रता का अनुभव होता है, जो एक प्रतिकूल रोगसूचक संकेत है।
- उपचार की प्रभावशीलता।लगभग 2 - 5% मामलों में ऐसे रूप होते हैं जो सभी प्रकार की चिकित्सा के लिए प्रतिरोधी होते हैं।
ए) ल्यूकोसाइट्स विशेष पदार्थ पैदा करने में सक्षम हैं - ल्यूकिन्स,जो सूक्ष्मजीवों की मृत्यु का कारण बनते हैं;
बी) कुछ ल्यूकोसाइट्स (बेसोफिल और ईोसिनोफिल) फॉर्म एंटीटॉक्सिन- विषहरण गुणों वाले पदार्थ;
सी) ल्यूकोसाइट्स एंटीबॉडी का उत्पादन करने में सक्षम हैं जो कर सकते हैं
शरीर में रहने का समय, इसलिए व्यक्ति का पुन: रोग असंभव हो जाता है;
डी) ल्यूकोसाइट्स (बेसोफिल, ईोसिनोफिल) रक्त जमावट और फाइब्रिनोलिसिस की प्रक्रियाओं से संबंधित हैं।
2. ल्यूकोसाइट्स पुनर्योजी को उत्तेजित करते हैं(दृढ़) शरीर में प्रक्रियाएं, घाव भरने में तेजी लाती हैं।
3. ल्यूकोसाइट्स (मोनोसाइट्स) विनाश की प्रक्रियाओं में सक्रिय रूप से शामिल हैंफागोसाइटोसिस के कारण शरीर की कोशिकाओं और ऊतकों का मरना।
4. ल्यूकोसाइट्स एक एंजाइमेटिक कार्य करते हैं, क्योंकि विभिन्न एंजाइम होते हैंइंट्रासेल्युलर पाचन की प्रक्रिया के कार्यान्वयन के लिए आवश्यक है।
प्लेटलेट्स
प्लेटलेट्स, या प्लेटलेट्स- ये 2-5 माइक्रोन के व्यास के साथ अनियमित गोल आकार की चपटी कोशिकाएँ होती हैं। मानव प्लेटलेट्स में नाभिक नहीं होते हैं।
प्लेटलेट मानदंड:(180-320) एक्स 10 9 / एल।
थ्रोम्बोसाइटोसिस -परिधीय रक्त में प्लेटलेट्स की मात्रा में वृद्धि।
थ्रोम्बोसाइटोपेनिया -परिधीय में प्लेटलेट्स में कमी रक्त।
प्लेटलेट्स के गुण
स्यूडोपोडिया (स्यूडोपोडिया) के निर्माण के कारण प्लेटलेट्स फागोसाइटोसिस और गति करने में सक्षम हैं।
प्लेटलेट्स के शारीरिक गुणों में शामिल हैं:
एक) आसंजन(ग्लूइंग) - एक विदेशी सतह का पालन करने की क्षमता, विशेष रूप से पोत की दीवार की क्षतिग्रस्त सतह पर;
बी ) एकत्रीकरण(क्लंपिंग) - एक साथ रहने की क्षमता।
3. प्लेटलेट्स बहुत आसानी से नष्ट हो जाते हैं।
4. प्लेटलेट्स कुछ जैविक रूप से सक्रिय पदार्थों को अवशोषित और मुक्त करने में सक्षम हैं: सेरोटोनिन, एड्रेनालाईन, नॉरपेनेफ्रिन।
प्लेटलेट्स की ये सभी विशेषताएं रक्तस्राव को रोकने में उनकी भागीदारी को निर्धारित करती हैं।
प्लेटलेट कार्य
प्रक्रिया में सक्रिय भाग लें खून का जमनातथा फिब्रिनोल्य्सिस(रक्त के थक्के का विघटन)।
प्लेटों में जैविक रूप से सक्रिय यौगिक पाए गए, जिसके कारण वे रक्तस्राव (हेमोस्टेसिस) को रोकने में शामिल हैं।
अभिनय करना सुरक्षात्मक कार्यबैक्टीरिया और फागोसाइटोसिस के समूहन के कारण।
काबिल कसरत करनाकुछ एंजाइम,न केवल प्लेटों के सामान्य कामकाज के लिए, बल्कि रक्तस्राव को रोकने की प्रक्रिया के लिए भी आवश्यक है।
परिवर्तन केशिका दीवार पारगम्यता.
हेमटोपोइजिस और उसका विनियमन
हेमटोपोइजिस (हेमटोपोइजिस) -रक्त कोशिकाओं के निर्माण, विकास और परिपक्वता की एक जटिल प्रक्रिया। हेमोपोइजिस हेमटोपोइजिस के विशेष अंगों में किया जाता है।
हेमटोपोइजिस की दो अवधियाँ हैं:
भ्रूण- भ्रूण के विकास के दौरान हेमटोपोइजिस होता है
प्रसवोत्तर -हेमटोपोइजिस बच्चे के जन्म के बाद होता है।
आधुनिक अवधारणाओं के अनुसार हेमटोपोइजिस की एकल मूल कोशिका पूर्वज कोशिका (स्टेम सेल) है,जिसमें से, मध्यवर्ती चरणों की एक श्रृंखला के माध्यम से, एरिथ्रोसाइट्स, ल्यूकोसाइट्स, लिम्फोसाइट्स, प्लेटलेट्स बनते हैं।
लाल रक्त कोशिकाएं लाल रक्त के साइनस में इंट्रावास्कुलर (वाहिका के अंदर) बनती हैंअस्थि मज्जा।
लाल रक्त कणिकाओं के निर्माण की प्रक्रिया कहलाती है एरिथ्रोपोएसिस।
एरिथ्रोपोएसिस की तीव्रता को संख्या द्वारा आंका जाता है रेटिकुलोसाइट्स- एरिथ्रोसाइट्स के अग्रदूत। आम तौर पर इनकी संख्या 1 - 2% होती है।
परिपक्व एरिथ्रोसाइट्स रक्त में 100-120 दिनों तक प्रसारित होते हैं।
लाल रक्त कोशिकाओं का विनाश मोनोन्यूक्लियर फैगोसाइटिक प्रणाली की कोशिकाओं के माध्यम से यकृत, प्लीहा, लाल अस्थि मज्जा में होता है।
ल्यूकोसाइट्स लाल अस्थि मज्जा में एक ही स्टेम सेल से अतिरिक्त रूप से (वाहन के बाहर) बनते हैं।इसी समय, ग्रैन्यूलोसाइट्स और मोनोसाइट्स लाल अस्थि मज्जा में परिपक्व होते हैं, और थाइमस ग्रंथि में लिम्फोसाइट्स, लिम्फ नोड्स, टॉन्सिल, एडेनोइड, जठरांत्र संबंधी मार्ग के लसीका गठन और प्लीहा। परिपक्व ल्यूकोसाइट्स अपने एंजाइमों और अमीबीय गतिशीलता की गतिविधि के कारण प्रणालीगत परिसंचरण में प्रवेश करते हैं।
ल्यूकोसाइट्स के निर्माण की प्रक्रिया को ल्यूकोपोइजिस कहा जाता है।
ल्यूकोसाइट्स का जीवन काल 15-20 दिनों तक होता है (कुछ घंटों, दिनों, हफ्तों तक जीवित रहते हैं, अन्य - एक व्यक्ति के जीवन भर)।
ल्यूकोसाइट्स पाचन तंत्र के श्लेष्म झिल्ली के साथ-साथ जालीदार ऊतक में नष्ट हो जाते हैं।
प्लेटलेट्स लाल अस्थि मज्जा में मेगाकारियोसाइट्स की विशाल कोशिकाओं से बनते हैं। पोत के बाहर विकसित करें।संवहनी बिस्तर में प्लेटलेट्स का प्रवेश अमीबिड गतिशीलता और उनके प्रोटीयोलाइटिक एंजाइमों की गतिविधि द्वारा प्रदान किया जाता है।
प्लेटलेट्स बनने की प्रक्रिया को थ्रोम्बोपोइजिस कहा जाता है।
प्लेटलेट्स की उम्र 5 से 11 दिन होती है।
तिल्ली और फेफड़ों में प्लेटलेट्स नष्ट हो जाते हैं।
रक्त कोशिकाओं का निर्माण नियमन के हास्य और तंत्रिका तंत्र के नियंत्रण में होता है।
हेमटोपोइजिस के नियमन के हास्य घटकों को, बदले में, दो समूहों में विभाजित किया जा सकता है: बहिर्जात और अंतर्जात कारक।
प्रति बहिर्जात कारकजैविक रूप से सक्रिय पदार्थ शामिल करें - बी विटामिन, विटामिन सी, फोलिक एसिड, साथ ही ट्रेस तत्व: लोहा, कोबाल्ट, तांबा, मैंगनीज। ये पदार्थ, हेमटोपोइएटिक अंगों में एंजाइमेटिक प्रक्रियाओं को प्रभावित करते हैं, गठित तत्वों की परिपक्वता और भेदभाव में योगदान करते हैं, उनके संरचनात्मक (घटक) भागों का संश्लेषण करते हैं।
प्रति अंतर्जात कारकहेमटोपोइजिस के नियमन में शामिल हैं: कैसल फैक्टर, हेमोपोइटिन, एरिथ्रोपोइटिन, थ्रोम्बोपोइटिन, ल्यूकोपोइटिन, अंतःस्रावी ग्रंथियों के कुछ हार्मोन। कैसल फैक्टरजटिल संबंध, जिसमें तथाकथित बाहरी और आंतरिक कारक प्रतिष्ठित हैं। बाहरी कारक - विटामिन बी 12; आंतरिक - एक प्रोटीन प्रकृति (गैस्ट्रोम्यूकोप्रोटीन) का पदार्थ, जो पेट के कोष की कोशिकाओं द्वारा निर्मित होता है। आंतरिक कारक गैस्ट्रिक जूस द्वारा विटामिन बी 12 को नष्ट होने से बचाता है और आंतों से इसके अवशोषण को बढ़ावा देता है। कैसल कारक एरिथ्रोपोएसिस को उत्तेजित करता है। एरिथ्रोपोइटिन- गठित तत्वों (ल्यूकोसाइट्स, प्लेटलेट्स, एरिथ्रोसाइट्स) के टूटने के उत्पादों का रक्त कोशिकाओं के निर्माण पर एक स्पष्ट उत्तेजक प्रभाव पड़ता है।
ल्यूकोपोइज़िस - ल्यूकोसाइट्स के गठन की प्रक्रिया, हेमटोपोइजिस के अंगों में होने वाले सेलुलर परिवर्तनों का एक क्रम, आमतौर पर अस्थि मज्जा के हेमटोपोइएटिक ऊतक में होता है। मायलोपोइज़िस हैं - ग्रैन्यूलोसाइट्स और मोनोसाइट्स की परिपक्वता, और लिम्फोपोइज़िस - लिम्फोसाइटों के गठन की प्रक्रिया।
ल्यूकोपोइजिस अस्थि मज्जा में एक स्टेम सेल (कक्षा I) के साथ शुरू होता है, जो असीमित आत्म-रखरखाव में सक्षम है और किसी भी परिधीय रक्त कोशिका (प्लुरिपोटेंट सेल) की परिपक्वता की प्रक्रिया को जन्म दे सकता है। हेमटोपोइएटिक वृद्धि कारकों (कॉलोनी-उत्तेजक कारक, इंटरल्यूकिन -3, -6, -7, ग्रैनुलोसाइट-मैक्रोफेज कॉलोनी-उत्तेजक कारक) के प्रभाव में, स्टेम सेल विभाजन आंशिक रूप से निर्धारित मायलोपोइजिस (सीएफयू-) के पूर्वज कोशिकाओं के गठन का कारण बन सकता है। HEMM) या लिम्फोपोइज़िस (कक्षा II)। कक्षा II कोशिकाएं एकरूप पूर्वज कोशिकाओं, या कॉलोनी बनाने वाली कोशिकाओं (वर्ग III) का निर्माण करती हैं, जो कड़ाई से परिभाषित दिशा में अंतर करती हैं: ग्रैनुलोसाइटोपोइजिस (CFU-GN, CFU-Ba, CFU-Eo), मोनोसाइटोपोइज़िस (CFU-M), B- लिम्फोपोइज़िस (सीएफयू-बी), टी-लिम्फोपोइज़िस (सीएफयू-टी)। कक्षा I, II और III की कोशिकाएँ रूपात्मक रूप से उदासीन होती हैं, वे छोटे गहरे लिम्फोसाइटों की तरह दिखती हैं, जिनमें बेसोफिलिक साइटोप्लाज्म के एक संकीर्ण रिम के साथ एक बड़े तीव्रता से सना हुआ घने नाभिक होता है। प्रत्येक कॉलोनी बनाने वाली कोशिका एक निश्चित संख्या में चरणों के माध्यम से एक परिपक्व ल्यूकोसाइट में अंतर करती है, जो विभिन्न प्रकार के ल्यूकोसाइट्स में भिन्न होती है। तृतीय श्रेणी की कोशिकाएँ विस्फोटों (वर्ग IV) में बदल जाती हैं। मायलोब्लास्ट्स में क्रोमेटिन की एक नाजुक जाल संरचना के साथ एक बड़ा गोल नाभिक होता है, साथ ही 2-5 न्यूक्लियोली, साइटोप्लाज्म का एक संकीर्ण रिम होता है जिसमें दाने नहीं होते हैं। लिम्फोब्लास्ट्स, मायलोब्लास्ट्स के विपरीत, एक स्पष्ट पेरिन्यूक्लियर ज़ोन, एक मोटे क्रोमैटिन संरचना और 1-2 न्यूक्लियोली होते हैं। कक्षा V (परिपक्व) की कोशिकाएँ विभिन्न चरणों से गुजरती हैं। ग्रैन्यूलोसाइट्स (न्यूट्रोफिल, ईोसिनोफिल और बेसोफिल) की परिपक्वता की प्रक्रिया में, उनका नाभिक मोटा हो जाता है और विभाजन से गुजरता है। साइटोप्लाज्म में, जब राइट के अनुसार दाग दिया जाता है, तो विशिष्ट न्यूट्रो-, ईओसिन- या बेसोफिलिक कणिकाएं दिखाई देती हैं। प्रोमायलोसाइट - कोशिकाओं में सबसे बड़ी (25 माइक्रोन तक व्यास) में बड़ी मात्रा में एज़ुरोफिलिक ग्रैन्युलैरिटी होती है, नाभिक में 1-2 नाभिक होते हैं। मायलोसाइट (व्यास 14-16 माइक्रोन) विभाजित करने में सक्षम अंतिम कोशिका है, नाभिक में कोई नाभिक नहीं होते हैं। मेटामाइलोसाइट (व्यास 12-15 माइक्रोन) में नाभिक की एक खाड़ी जैसी छाप होती है, साइटोप्लाज्म में एक नाजुक विशिष्ट ग्रैन्युलैरिटी होती है। स्टैब ल्यूकोसाइट्स में, नाभिक में एक घुमावदार छड़ का आकार होता है। सेगमेंटोन्यूक्लियर ग्रैन्यूलोसाइट्स परिपक्व कोशिकाएं (कक्षा VI) हैं, जिनमें से नाभिक में 2-4 खंड होते हैं।
ल्यूकोपोइज़िस के सभी चरणों को संबंधित हास्य कारकों द्वारा नियंत्रित किया जाता है साइटोकिन्स. मुख्य हैं कॉलोनी उत्तेजक कारक (सीएसएफ) और हेमटोपोइएटिक कारक. CSF स्वाभाविक रूप से ग्लाइकोप्रोटीन होते हैं। ये सभी प्लुरिपोटेंट या हेमटोपोइएटिक स्टेम सेल से शुरू होकर विभिन्न हेमटोपोइएटिक कॉलोनियों की परिपक्वता और भेदभाव का समर्थन करते हैं। यह तथाकथित स्टेम सेल कारकया शैली प्रोटीन कारक (एससीएफ या एसएफ), ग्रैनुलोसाइट-मैक्रोफेज (ग्राम-सीएसएफ),ग्रैनुलोसाइटिक (जी-सीएसएफ) तथा बृहतभक्षककोशिका (एम- CSF)कोशिका समूह का वृद्धि कारक, एरिथ्रोपीटिन, थ्रोम्बोपोइटिनऔर दूसरे। सभी कॉलोनी-उत्तेजक कारक (सीएसएफ) अस्थि मज्जा स्ट्रोमल तत्वों, फाइब्रोब्लास्ट्स, एंडोथेलियोसाइट्स, मैक्रोफेज और कुछ प्रकार के टी-लिम्फोसाइटों द्वारा निर्मित होते हैं। यह माना जाता है कि अस्थि मज्जा में इन यौगिकों का शारीरिक स्तर स्ट्रोमल कोशिकाओं के संपर्क संपर्क के परिणामस्वरूप कमजोर सक्रिय आवेगों की क्रिया के परिणामस्वरूप प्राप्त होता है। हालांकि, विभिन्न एंटीजन के प्रभाव में होने वाली प्रतिरक्षा प्रतिक्रिया के दौरान सीएसएफ का बढ़ा हुआ गठन भी हो सकता है। नीचे उनका संक्षिप्त विवरण दिया गया है।
एस सी एफ- हेमटोपोइएटिक और ऊतक वृद्धि कारक या शैली कारक (एसएफ)सी-किट-ओंकोजीन के लिए एक लिगैंड के रूप में कार्य करना और विभिन्न प्रकार की कोशिकाओं द्वारा निर्मित - अस्थि मज्जा स्ट्रोमा, फाइब्रोब्लास्ट, उपकला कोशिकाएं और संवहनी एंडोथेलियम। घुलनशील और झिल्ली बाध्य SCF है। शैली कारक का प्रभाव अत्यंत विविध है। यह यौगिक pHSCs के प्रसार और विभेदन को बढ़ावा देता है, साथ ही साथ विभिन्न हेमटोपोइएटिक वंशावली के पूर्वज कोशिकाओं को भी बढ़ावा देता है। स्टेम सेल पर SCF और IL-11 की कार्रवाई के साथ-साथ लिम्फोसाइटों पर IL-2 के साथ सहक्रियावाद का पता चला था, जिन्हें प्राकृतिक हत्यारे या NK-लिम्फोसाइट्स नाम दिया गया था। यह माना जाता है कि एससीएफ स्थानीय रूप से अस्थि मज्जा में बनता है और एक "एंकर कारक" के रूप में कार्य करता है, जिससे हेमटोपोइएटिक कोशिकाओं पर अन्य साइटोकिन्स की क्रिया को सुविधाजनक बनाया जाता है।
प्रति हाल के समय मेंपाया गया कि ईोसिनोफिल्स की परिपक्वता प्रभावित होती है ईोसिनोफिलिक कॉलोनी उत्तेजक कारक (ईओ-सीएसएफ)), और बेसोफिल पर - मस्तूल सेल कॉलोनी उत्तेजक कारक. हालांकि, उनके गुणों को अभी भी कम समझा जाता है।
ल्यूकोपोइज़िस में लगभग सभी इंटरल्यूकिन भाग लेते हैं। मुख्य है आईएल-3,जो उत्तेजित टी-लिम्फोसाइट्स, मोनोसाइट्स, मैक्रोफेज, थाइमस एपिथेलियल कोशिकाओं, केराटिनोसाइट्स, मस्तूल और यहां तक कि तंत्रिका कोशिकाओं द्वारा स्रावित होता है। यह हेमटोपोइएटिक पूर्वज कोशिकाओं को उत्तेजित करता है, अर्थात। एक पॉलीपोइटिन है। ग्रैनुलोसाइटिक-मैक्रोफेज कॉलोनियों, एरिथ्रोसाइट और मेगाकारियोसाइटिक स्प्राउट्स के विकास और विकास को सुनिश्चित करता है, श्लेष्म झिल्ली, बेसोफिल, ईोसिनोफिल, साथ ही टी- और बी-लिम्फोसाइटों के अग्रदूतों में स्थानीयकृत मस्तूल कोशिकाएं। आईएल-3 का ईोसिनोफिलोपोइजिस पर विशेष रूप से स्पष्ट प्रभाव पड़ता है, जिसके कारण इसे ईोसिनोफिलोपोएटिक कहा जाता है।
यह ध्यान दिया जाना चाहिए कि अधिकांश साइटोकिन्स हेमटोपोइजिस की प्रक्रियाओं को तभी प्रभावित करते हैं जब वे एक ही पहनावा में एक साथ कार्य करते हैं। इसके अलावा, वही साइटोकिन प्रभावित कर सकता है विभिन्न कोशिकाएंलक्ष्य और, अंत में, व्यक्तिगत साइटोकिन्स का प्रभाव अक्सर न केवल मात्रात्मक रूप से, बल्कि गुणात्मक रूप से इन सबसे महत्वपूर्ण हेमटोपोइएटिक नियामकों के अन्य प्रतिनिधियों की उपस्थिति में भी महत्वपूर्ण रूप से बदलता है।
इस प्रकार, शरीर में एक ही परिसर होता है संगठित प्रणालीहेमटोपोइजिस का विनियमन, जिसमें बारीकी से परस्पर दूर और स्थानीय नियंत्रण संरचनाएं शामिल हैं। शरीर पर विभिन्न चरम कारकों की कार्रवाई के तहत, हेमटोपोइजिस के नियमन के तंत्र के एकल कैस्केड के व्यक्तिगत लिंक क्रमिक रूप से सक्रिय होते हैं। उसी समय, केंद्रीय न्यूरोएंडोक्राइन तंत्र ट्रिगर होते हैं, जो सार्वभौमिक तनाव-साकार और तनाव-सीमित प्रणालियों के माध्यम से अपने प्रभाव का प्रयोग करते हैं। इसी समय, हेमटोपोइजिस पर वानस्पतिक प्रभाव डालने वाली मुख्य कड़ी सहानुभूति-अधिवृक्क प्रणाली है। इसके प्रभाव में, अस्थि मज्जा हेमटोपोइजिस की प्रक्रिया तेज हो जाती है, और रक्त की "सेलुलरिटी" बढ़ जाती है।
12. ग्रैनुलोसाइटोपोइजिस। चरण। विनियमन के कारक और तंत्र।
ग्रैनुलोसाइटोपोइज़िस कोशिकाओं का विभेदन और परिपक्वता अस्थि मज्जा में होती है, जहां माइलोब्लास्ट्स, प्रोमाइलोसाइट्स और मायलोसाइट्स से युक्त ग्रैनुलोसाइट्स का एक पूल प्रतिबद्ध, रूपात्मक रूप से अज्ञात अग्रदूत कोशिकाओं सीएफयू-जीएम (ग्रैनुलोमोनोसाइटोपोइज़िस की कॉलोनी बनाने वाली इकाई) और सीएफयू से बनता है। जी (ग्रैनुलोसाइटोपोइजिस की कॉलोनी बनाने वाली इकाई)। इन सभी कोशिकाओं को विभाजित करने की क्षमता की विशेषता है। अस्थि मज्जा में गठित एक और पूल गैर-प्रसार (परिपक्व) कोशिकाएं हैं - मेटामाइलोसाइट्स, स्टैब और खंडित ग्रैन्यूलोसाइट्स। कोशिकाओं की परिपक्वता उनके आकारिकी में परिवर्तन के साथ होती है: नाभिक में कमी, क्रोमेटिन का संघनन, नाभिक का गायब होना, नाभिक का विभाजन, विशिष्ट ग्रैन्युलैरिटी की उपस्थिति, बेसोफिलिया की हानि, और की मात्रा में वृद्धि कोशिका द्रव्य। मायलोब्लास्ट से परिपक्व ग्रैनुलोनाइटिस के गठन की प्रक्रिया अस्थि मज्जा में 10-13 दिनों के भीतर की जाती है। ग्रैनुलोसाइटोपोइजिस का विनियमन कॉलोनी-उत्तेजक कारकों द्वारा प्रदान किया जाता है: जीएम-सीएसएफ (ग्रैनुलोसाइट-मैक्रोफेज कारक) और जी-सीएसएफ (ग्रैनुलोसाइट कॉलोनी-उत्तेजक कारक), ग्रैनुलोसाइट्स की परिपक्वता के अंतिम चरण तक कार्य करते हैं।
देर से मायलोब्लास्ट्स और प्रोमाइलोसाइट्स के चरण में, प्राथमिक कणिकाओं (एज़ुरोफिलिक ग्रैन्युलैरिटी) का निर्माण होता है, जिसका विशिष्ट मार्कर मायलोपरोक्सीडेज है। माइलोसाइट्स के साइटोप्लाज्म में, विशिष्ट ग्रैन्युलैरिटी (द्वितीयक कणिकाओं) का निर्माण शुरू होता है। माध्यमिक ग्रेन्युल मार्कर लैक्टोफेरिन, कैथेलिसिडियम कैशनिक प्रोटीन, बी 12-बाध्यकारी प्रोटीन और अन्य कारक हैं। द्वितीयक कणिकाओं की संरचना में लाइकोजाइम, कोलेजनेज़, मेटालोप्रोटीनिस भी शामिल हैं। कोशिका में परिपक्व होने पर द्वितीयक कणिकाओं की संख्या बढ़ जाती है, परिपक्व खंडीय ग्रैन्यूलोसाइट्स में वे 70-90% के लिए खाते हैं, शेष 10-30% अज़ूरोफिलिक ग्रैन्युलैरिटी है। परिपक्व अस्थि मज्जा ग्रैन्यूलोसाइट्स एक ग्रैनुलोसाइट अस्थि मज्जा रिजर्व बनाते हैं, जिसकी संख्या लगभग 8.8 बिलियन/किलोग्राम होती है और जीवाणु संक्रमण में एक विशिष्ट संकेत के जवाब में जुटाई जाती है। अस्थि मज्जा को छोड़कर, ग्रैन्यूलोसाइट्स पूरी तरह से विभेदित कोशिकाएं हैं जिनमें सतह के रिसेप्टर्स की एक पूरी श्रृंखला होती है और कई जैविक रूप से सक्रिय पदार्थों के एक सेट के साथ साइटोप्लाज्मिक ग्रैन्यूल होते हैं।
न्यूट्रोफिलरक्त ल्यूकोसाइट्स की कुल संख्या का 60-70% बनाते हैं। अस्थि मज्जा से परिधीय रक्त में न्यूट्रोफिलिक ग्रैन्यूलोसाइट्स की रिहाई के बाद, उनमें से कुछ संवहनी बिस्तर (परिसंचारी पूल) में मुक्त परिसंचरण में रहते हैं, अन्य पार्श्विका स्थिति पर कब्जा कर लेते हैं, एक सीमांत पूल बनाते हैं। एक परिपक्व न्यूट्रोफिल 8-10 घंटे तक परिसंचरण में रहता है, फिर ऊतकों में प्रवेश करता है, संख्या के संदर्भ में कोशिकाओं का एक महत्वपूर्ण पूल बनाता है। ऊतकों में एक न्यूट्रोफिलिक ग्रैनुलोसाइट का जीवन काल 2-3 दिन है। न्यूट्रोफिल का कार्य सूक्ष्मजीवों के खिलाफ उनके फागोसाइटोसिस द्वारा लड़ाई में भाग लेना है। दानों की सामग्री लगभग किसी भी रोगाणुओं को नष्ट कर सकती है। न्यूट्रोफिल में कई एंजाइम होते हैं (एसिड प्रोटेनियस, मायलोपरोक्सीडेज, लाइसोजाइम, लैक्टोफेरिन, पूरे फॉस्फेट, आदि) जो बैक्टीरियोलिसिस और सूक्ष्मजीवों के पाचन का कारण बनते हैं।
इयोस्नोफिल्ससभी रक्त ल्यूकोसाइट्स का 0.5-5% बनाते हैं, 6-12 घंटे तक घूमते हैं, जिसके बाद वे ऊतकों में प्रवेश करते हैं, आधा जीवन 12 दिन है। कोशिकाओं में महत्वपूर्ण मात्रा में दाने होते हैं, जिनमें से मुख्य घटक मुख्य क्षारीय प्रोटीन होता है, साथ ही जीवाणुनाशक गतिविधि वाले पेरोक्साइड भी होते हैं। ग्रेन्युल में एसिड फॉस्फेट, एरिलसल्फेटेज, कोलेजेनेज, इलास्टेज, ग्लुकुरोएडेस, कैथेप्सिन, मायलोनेरोक्सीडेज और अन्य एंजाइम पाए जाते हैं। कमजोर फागोसाइटिक गतिविधि रखने के कारण, ईोसिनोफिल्स बाह्य कोशिकीय साइटोलिसिस का कारण बनते हैं, जिससे कृमिनाशक प्रतिरक्षा में भाग लेते हैं। इन कोशिकाओं का एक अन्य कार्य एलर्जी प्रतिक्रियाओं में भाग लेना है।
basophilsऔर मस्तूल कोशिकाएं अस्थि मज्जा मूल की होती हैं। यह माना जाता है कि मस्तूल कोशिका के अग्रदूत अस्थि मज्जा को छोड़ देते हैं और परिधीय रक्त के माध्यम से ऊतकों में प्रवेश करते हैं। अस्थि मज्जा में बेसोफिल का अंतर 1.5-5 दिनों तक रहता है। बेसोफिल और मस्तूल कोशिकाओं के विकास कारक IL-3, IL-4 हैं। परिपक्व बेसोफिल रक्तप्रवाह में प्रवेश करते हैं, जहां उनका आधा जीवन लगभग 6 घंटे होता है। बेसोफिल रक्त ल्यूकोसाइट्स की कुल संख्या का केवल 0.5% है। बेसोफिल ऊतकों में चले जाते हैं, जहां वे मुख्य प्रभावकारक कार्य के कार्यान्वयन के 1-2 दिन बाद मर जाते हैं। इन कोशिकाओं के कणिकाओं में हिस्टामाइन, चोंड्रोइगिन सल्फेट्स ए और सी, हेपरिन, सेरोटोनिन, एंजाइम (ट्रिप्सिन, काइमोथ्रिनसिया, पेरोक्सीडेज, आरनेज, आदि) होते हैं। बेसोफिल्स के पास है कोशिका झिल्ली उच्च घनत्वआईजीई के लिए रिसेप्टर्स, न केवल आईजीई के बंधन प्रदान करते हैं, बल्कि कणिकाओं की रिहाई भी प्रदान करते हैं, जिनमें से सामग्री एलर्जी प्रतिक्रियाओं के विकास को निर्धारित करती है। बेसोफिल फागोसाइटोसिस में भी सक्षम हैं। मस्त कोशिकाएं बेसोफिल से बड़ी होती हैं, एक गोल नाभिक और कई दाने होते हैं, जो कि बेसोफिल कणिकाओं की संरचना के समान होते हैं।
13. एग्रानुलोसाइटोपोइजिस। मोनोसाइटोपोइजिस। चरण। मैक्रोफेज गठन के नियमन के कारक और तंत्र। मैक्रोफेज की किस्में (+ ल्यूकोपोइज़िस)
मोनोसाइट्स और मैक्रोफेजमोनोन्यूक्लियर फागोसाइट्स (एमपीएस) या आई.आई. के मैक्रोफेज सिस्टम की मुख्य कोशिकाएं हैं। मेचनिकोव। इस प्रणाली में एकजुट कोशिकाएं भेदभाव की एक पंक्ति का निर्माण करती हैं, जिनमें शामिल हैं:
अस्थि मज्जा अग्रदूत
परिसंचारी अपेक्षाकृत अपरिपक्व कोशिकाओं का एक पूल
रक्त में (मोनोसाइट्स),
विभेदन का अंतिम चरण अंग- और ऊतक-विशिष्ट मैक्रोफेज है।
मोनोन्यूक्लियर फागोसाइट्स के प्रारंभिक अग्रदूत एक प्लुरिपोटेंट हेमटोपोइएटिक स्टेम सेल से उत्पन्न होते हैं और ग्रैनुलोमोनोसाइटोपोइज़िस अग्रदूत कोशिकाओं - सीएफयू-जीएम का तेजी से विभाजित पूल हैं। प्रतिबद्ध सीएफयू-जीएम मोनोब्लास्ट्स के एक प्रोलिफायरिंग पूल को जन्म देते हैं, और मोनोब्लास्ट प्रोमोनोसाइट्स के एक पूल को जन्म देते हैं। उत्तरार्द्ध सामान्य अस्थि मज्जा में सबसे पहले रूपात्मक रूप से पहचाने जाने वाले एसएमएफ कोशिकाएं हैं, जिनमें उच्च प्रसार क्षमता होती है।
शारीरिक स्थितियों के तहत, 2-3 डिवीजनों के बाद प्रोमोनोसाइट्स मोनोसाइट्स में अंतर करते हैं, जो ग्रैनुलोसाइटिक श्रृंखला की कोशिकाओं के विपरीत, अस्थि मज्जा में परिपक्वता के चरण से नहीं गुजरते हैं, लेकिन तुरंत रक्तप्रवाह में प्रवेश करते हैं। नतीजतन, अस्थि मज्जा में मोनोसाइट्स का कोई महत्वपूर्ण आरक्षित पूल नहीं है, उनकी कुल संख्या हेमटोपोइजिस के सभी परमाणु तत्वों के 1.5% से अधिक नहीं है। मोनोसाइट्स का एक अपेक्षाकृत छोटा अनुपात अस्थि मज्जा मैक्रोफेज में अंतर करता है।
मोनोसाइट्स का उत्पादन वृद्धि कारकों के एक पूरे समूह द्वारा नियंत्रित किया जाता है, जिनमें से कुछ (IL-3, GM-CSF और M-CSF) मोनोसाइट अग्रदूतों, अन्य (PgE, INFa) की माइटोटिक गतिविधि को उत्तेजित करते हैं और इनके विभाजन को रोकते हैं। कोशिकाओं। रक्तप्रवाह से मोनोसाइट्स का नियमित रूप से ऊतकों में प्रवास, विशेष आसंजन अणुओं के मोनोसाइट्स और एंडोथेलियल कोशिकाओं पर अभिव्यक्ति द्वारा मध्यस्थता। इन अणुओं की अभिव्यक्ति प्रो-भड़काऊ साइटोकिन्स के प्रभाव में बढ़ जाती है: आईएल -1, टीएनएफए, आईएल -6 , INF-y। सक्रिय एंडोथेलियल कोशिकाओं के लिए मोनोसाइट्स का आसंजन सतह अणुओं द्वारा मध्यस्थता है CD11a / CD18, VLA-4, ICAM-1, VCAM-1 इसके बाद एंडोथेलियल कोशिकाओं की सतह पर मोनोसाइट्स का प्रसार होता है, दो पड़ोसी के बीच प्रवेश एंडोथेलियोसाइट्स, तहखाने की झिल्ली पर काबू पाने और ऊतकों में बाहर निकलने के लिए। यह प्रक्रिया एक सामान्य कदम है जीवन चक्रमोनोसाइट्स ऊतकों में रक्तप्रवाह से बाहर निकलने के बाद, मोनोसाइट्स अंग- और ऊतक-विशिष्ट मैक्रोफेज में अंतर करते हैं और पुनर्चक्रण में सक्षम नहीं होते हैं।
मैक्रोफेज।परिपक्व मैक्रोफेज कई सामान्य साझा करते हैं रूपात्मक विशेषताएं: महत्वपूर्ण आकार (20-25 से 80 माइक्रोन तक व्यास), अंडाकार नाभिक, लूपिंग क्रोमैटिन और न्यूक्लियोली के अवशेष के साथ, स्यूडोपोडिया की उपस्थिति के साथ स्पष्ट सीमाओं के बिना विस्तृत साइटोप्लाज्म। मैक्रोफेज प्रणाली की कोशिकाओं का अतिरिक्त संवहनी पूल रक्त में उनकी सामग्री से काफी अधिक है; सबसे बड़ी संख्यामैक्रोफेज यकृत, प्लीहा और फेफड़ों में पाए जाते हैं। ऊतक मैक्रोफेज लंबे समय तक जीवित रहने वाली कोशिकाएं हैं, उनके जीवन काल की गणना महीनों और वर्षों में की जाती है। यदि वे संक्रमण या सूजन के स्थान पर नहीं जाते हैं, तो वे मर जाते हैं, प्लीहा या लिम्फ नोड्स की ओर पलायन करते हैं। फुफ्फुसीय मैक्रोफेज वायुमार्ग के माध्यम से फेफड़ों को छोड़ देते हैं। ऊतक मैक्रोफेज के पूल का नवीनीकरण रक्तप्रवाह से मोनोसाइट्स के प्रवाह के कारण होता है, मैक्रोफेज का केवल एक छोटा सा हिस्सा (5% से कम) एक बार विभाजित होने की क्षमता दिखाता है।
सूक्ष्म पर्यावरण और कार्यों की विशेषज्ञता के प्रभाव में, अंगों और ऊतकों के मैक्रोफेज स्पष्ट रूपात्मक और प्राप्त करते हैं कार्यात्मक विशेषताएं, जिसके अनुसार कोशिकाओं के दो मुख्य वर्ग प्रतिष्ठित हैं: प्रतिजन-प्रसंस्करण मैक्रोफेज(पर्यायवाची - पेशेवर फागोसाइट्स) और एंटीजन प्रस्तुत करने वाले वृक्ष के समान कोशिकाएं(प्रतिरक्षा एक्सेसर्स के समानार्थी)।
पेशेवर फागोसाइट्स के वर्ग में संयोजी ऊतक के मुक्त मैक्रोफेज, चमड़े के नीचे की वसा परत, सीरस गुहाएं, फेफड़ों के वायुकोशीय मैक्रोफेज, यकृत के निश्चित मैक्रोफेज, केंद्रीय तंत्रिका तंत्र, अस्थि मज्जा, प्लीहा और लिम्फ नोड्स, साथ ही ओस्टियोक्लास्ट, एपिथेलिओइड शामिल हैं। सूजन फॉसी की कोशिकाएं और विशाल बहुसंस्कृति कोशिकाएं। रूपात्मक विशेषताओं में तेज अंतर के बावजूद, इन कोशिकाओं में समान साइटोकेमिकल (अल्फा-नेफ्थाइल एसीटेट एस्टरेज़+, एसिड फॉस्फेट+, लाइसोजाइम+) और इम्यूनोफेनोटाइपिक विशेषताएं (Fc-lgG+, CD4+, CD11+, CD14+) हैं, जो उनकी एक सामान्य रेखा से संबंधित होने की पुष्टि करते हैं। पेशेवर फागोसाइट्स का मुख्य कार्य हमलावर सूक्ष्मजीवों, क्षतिग्रस्त, पतित और वायरस से संक्रमित कोशिकाओं के साथ-साथ प्रतिरक्षा परिसरों और शरीर में प्रवेश करने वाले कार्बनिक और अकार्बनिक प्रकृति की विभिन्न वस्तुओं का अवशोषण और विनाश है। पेशेवर फागोसाइट्स के कार्यों में जैविक रूप से सक्रिय उत्पादों (मोनोकाइन्स) का स्राव और लिम्फोसाइटों के लिए एंटीजन की प्रस्तुति भी शामिल है, हालांकि, बाद के संबंध में वे डेंड्राइटिक कोशिकाओं की तुलना में बहुत कम कुशल हैं।
कुछ कारकों (साइटोकिन्स जीएमसीएसएफ, टीएनएफए और आईएल -4) की उपस्थिति में रक्त मोनोसाइट्स वृक्ष के समान कोशिकाओं में अंतर करते हैं।



.jpg)
